Анилин и его свойства и противопоказания
 История анилина началась в XIX веке. Сегодня продукция, изготовленная на его основе, прочно вошла в повседневный обиход. За это время учёные, эксперты производства всесторонне изучили свойства популярного реагента. Анилин (аминобензол, фениламин) является сильнодействующим ядом. Попадая в организм человека, он парализует систему доставки кислорода к тканям.
История анилина началась в XIX веке. Сегодня продукция, изготовленная на его основе, прочно вошла в повседневный обиход. За это время учёные, эксперты производства всесторонне изучили свойства популярного реагента. Анилин (аминобензол, фениламин) является сильнодействующим ядом. Попадая в организм человека, он парализует систему доставки кислорода к тканям.
Давайте выясним, что такое анилин, историю его открытия, физические и химические свойства, где он сейчас применяется, какие симптомы указывают на острое и хроническое отравление им, о последствия интоксикации и мерах профилактики.
Что такое анилин
Это органическое соединение, которое относится к классу ароматических аминов. Впервые получил анилин немецкий химик Отто Унфердорбен в 1826 году, дав ему название кристаллин. Но на этом его история открытия не закончилась. На протяжении следующих 17 лет во время исследований разных учёных его получали ещё трижды.
- В 1834 г. немецкий химик-органик Фридлиб Фердинанд Рунгe выявил анилин в каменноугольной смоле, дав ему название кианол.
- В 1840 г. немецко-русский химик Юлий Фёдорович Фрицше получил это вещество путём нагревания индиго с раствором гидроксида калия, назвав его анилином.
- В 1842 г. русский химик-органик Николай Николаевич Зинин синтезировал анилин путём восстановления нитробензола действием сульфида аммония, назвав его бензидамом.
И лишь в 1843 г. немецкий химик-органик Август Вильгельм Гофман установил общность этих соединений, названных разными именами.
Способы получения
Основной способ синтеза анилина — восстановление нитробензола. Сегодня в качестве восстановителя обычно применяют водород. Это самый распространённый промышленный метод получения анилина.
Часть производственных процессов позволяет использовать в роли восстановителей другие вещества — металлы (железо, цинк, олово), соли (хлорид олова, сульфиды щелочных металлов), сероводород. Успешно применяются в производстве каталитический и электрохимический методы восстановления.
Физические и химические свойства
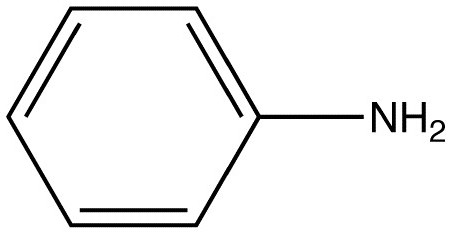
Формула анилина — C6H5NH2 содержит аминогруппу, поэтому вещество имеет второе название — фениламин. А также благодаря присутствию бензольной группы, он известен как аминобензол.
По своим физическим свойствам анилин — это бесцветная маслянистая жидкость, малорастворимая в воде. Имеет неприятный аммиачный запах. При горении образует яркое коптящее пламя. Температура кипения анилина составляет 184,4 °C. Это горючее вещество — при нагревании выше 70 °C могут образоваться взрывоопасные соединения. На воздухе анилин легко окисляется и приобретает красно-бурый цвет.
Благодаря химическим свойствам взаимодействует с сильными неорганическими кислотами (соляная, серная, фосфорная) и образует соли.
Применение
Анилин — это одно из первых органических соединений, полученных искусственным путём. Его открытие привело к созданию нескольких успешных отраслей.
В промышленности
Производственное использование анилина охватывает различные области — от получения ракетного топлива до изготовления крема для обуви.
Анилин и его соединения применяют в производстве:
- полиуретанов (конструкционные материалы, тепло- и звукоизоляция);
- ускорителей для вулканизации на основе натурального и синтетических каучуков (шины, резинотехнические изделия, резиновая обувь);
- красителей для тканей;
- эпоксидных полимеров;
- взрывчатых веществ;
- ингибиторов коррозии металлов;
- моторного топлива;
- смол, лаков.
Красители на основе анилина придают яркий цвет натуральным и синтетическим тканям, коже, шерсти, овчине. Однако существенным недостатком такого окрашивания является выгорание на солнце и низкая устойчивость к воздействию воды.
Анилин и его соединения являются сырьём для изготовления сложных промежуточных продуктов. Кроме основных областей применения, анилин используют при производстве гербицидов, пестицидов, фунгицидов, типографской краски, чернил, реактивов для фотографии, духов.
В медицине
Анилин является сырьём для фармакологической промышленности. Лекарства, изготовленные с его применением, оказывают следующее действие:
- обезболивающее, жаропонижающее — анальгин, бутадион;
- антимикробное — этазол, сульфален, сульгин, сульфаниламид, бисептол;
- нейролептическое — аминазин, пропазин.
Производные анилина входят в состав медицинских красителей. Метиленовый синий оказывает антисептическое, анальгезирующее действие. Генцианвиолет применяется как антибактериальное, противоглистное, местное противовоспалительное средство. Фуксин используют для местного лечения гнойничковых и грибковых заболеваний кожи, себореи. Красители применяют в бактериологических исследованиях для окраски микроорганизмов.
Действие на организм человека
Анилин является сильным ядом, высокотоксичным для человека. Чаще всего интоксикация развивается при поступлении вещества через дыхательные пути, неповреждённую кожу и слизистые оболочки — ротовую полость, глаза. Небольшое количество может проникать через желудок.
Выводится вещество из организма в основном через почки. Оставшаяся часть выходит через дыхательные пути.
Анилин является гемотоксином, то есть наносящим вред крови человека. Механизм анилинового отравления состоит в образовании метгемоглобина, разрушении эритроцитов. Блокируется транспорт кислорода, что ведёт к поражению центральной нервной системы.
Кроме инактивации гемоглобина, токсичность анилина проявляется в развитии острой дыхательной, сердечно-сосудистой, почечной, печёночной недостаточности.
Накапливается анилин в печени и жировой ткани, создавая депо. Горячий душ, сауна, баня, приём алкоголя могут спровоцировать повторный выход токсина из депо в кровь, вызвав ухудшение состояния даже спустя две недели.
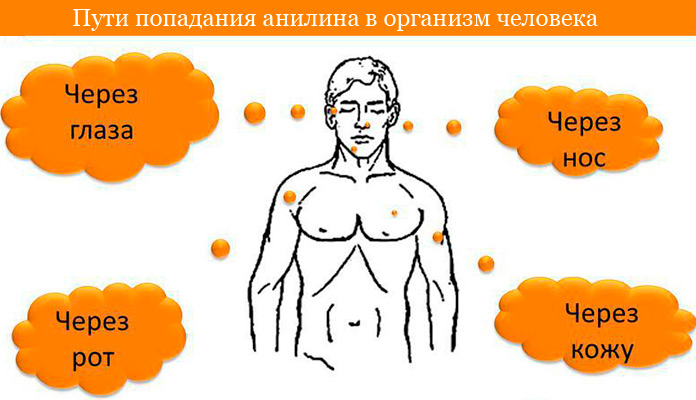
Отравление анилином
При кипении анилин образует пары, которые тяжелее воздуха. В производстве красителей, высока опасность отравления при соприкосновении с его растворами.
Причины отравления:
- непосредственный контакт с веществами в процессе их производства, хранения и применения;
- передозировка лекарственных препаратов;
- суицидальные попытки (нейролептиками);
- нарушения требований техники безопасности на производстве или в домашних условиях;
- аварии на промышленных объектах;
- загрязнение атмосферы ядовитыми парами, водоёмов стоками.
Отравление анилиновыми красителями может произойти в домашних условиях. Их используют для изменения цвета тканей, нанесения рисунков. Концентрация, состав красок рассчитаны на применение вне производственных объектов. Перед началом работы необходимо внимательно прочитать инструкцию. Соблюдение её пунктов обезопасит от случайной интоксикации.
Симптомы острого отравления
Степень тяжести состояния пострадавшего зависит от пути попадания вещества, его концентрации, исходного самочувствия человека. Клиника острого отравления анилином характерна для «яда крови».
Симптомы интоксикации лёгкой степени:

- жалобы на головную боль, слабость, недомогание, диспепсию в виде тошноты, рвоты;
- после приёма внутрь — боль в подложечной области;
- при осмотре выявляется синюшность губ, носогубного треугольника, ушных раковин, ногтей — акроцианоз.
Симптомы отравления средней степени:
- жалобы на сильную головную боль, тяжесть и болезненность в правом подреберье;
- изменения поведения — беспокойство, раздражительность, двигательное возбуждение;
- при осмотре — желтушность склер, выраженный акроцианоз;
- двигательные нарушения в виде неустойчивости при ходьбе;
- затруднение дыхания (одышка), усиленное отделение мокроты;
- учащение пульса.
Симптомы острого отравления анилином тяжёлой степени:
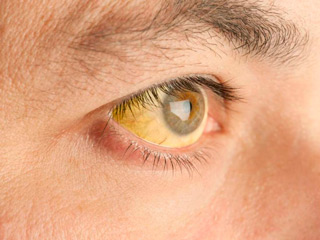
- синюшность кожного покрова, слизистых;
- желтушность кожи, склер;
- угнетение сознания до комы;
- развитие судорожного синдрома;
- одышка, учащение или урежение, патологический характер дыхательных движений (поверхностное, неритмичное);
- снижение артериального давления, учащение пульса, невозможность его определить на лучевой артерии;
- отсутствие мочеиспускания.
Синюшность при отравлении анилином имеет характерный оттенок. Его придаёт коричневый цвет метгемоглобина и красно-синеватый тон поражённого эритроцита. Кожа, губы приобретают сине-чёрный цвет.
На фоне нарастающей сердечно-сосудистой и дыхательной недостаточности наступает остановка кровообращения.
Симптомы хронического отравления
 Клинические проявления хронической интоксикации анилином развиваются постепенно и являются неспецифичными по своему характеру. Человека беспокоят головные боли, слабость, быстрое утомление, расстройства сна. Близкие, коллеги отмечают его возросшую раздражительность, снижение внимания, памяти. У пострадавшего наблюдаются симптомы поражения желудочно-кишечного тракта, печени, почек.
Клинические проявления хронической интоксикации анилином развиваются постепенно и являются неспецифичными по своему характеру. Человека беспокоят головные боли, слабость, быстрое утомление, расстройства сна. Близкие, коллеги отмечают его возросшую раздражительность, снижение внимания, памяти. У пострадавшего наблюдаются симптомы поражения желудочно-кишечного тракта, печени, почек.
Появляются шаткость походки, мышечные подёргивания. Характерны признаки расстройства зрительного аппарата — утомляемость глаз, светобоязнь, снижение остроты зрения. Возможно, образование сыпи на коже.
Симптомы не угрожают жизни, но при отсутствии лечения приводят к глубокой инвалидизации.
Первая помощь при остром отравлении
После прекращения вдыхания анилина или контакта с реагентами его содержащими, метгемоглобин в крови начинает распадаться. Восстанавливается транспорт кислорода к тканям, устраняется причина интоксикации.
При остром отравлении анилином, важна правильная последовательность оказания первой помощи. Её необходимо начинать с прекращения поступления яда в организм: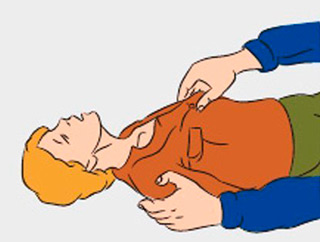
- устранить источник;
- проветрить помещение;
- снять загрязнённую одежду;
- если состояние пострадавшего позволяет — перенести его в безопасное место.
Мероприятия первой помощи при остром отравлении анилином:
- обратиться к медицинским специалистам (служба «скорой помощи», фельдшер здравпункта);
- промыть чистой водой глаза, прополоскать рот;
- при угнетении сознания нельзя поить, давать таблетки, пытаться промывать желудок;
- до приезда медицинских специалистов наблюдать за сознанием пострадавшего, его дыханием и частотой пульса;
- при развитии терминального состояния проводить сердечно-лёгочную реанимацию.
При суицидальных попытках с использованием нейролептиков, содержащих анилин, промывание желудка можно проводить только в случае ясного сознания и удовлетворительного состояния. То есть, практически сразу после приёма препаратов. При их всасывании снижается артериальное давление, угнетается кашлевой рефлекс, сознание. Манипуляция может осложниться аспирацией желудочного содержимого (затекание в дыхательные пути), развитием острой сердечной и сосудистой недостаточности.
Лечение
Диагностика отравления анилином проводится на основании сбора анамнеза, клинического обследования, результатов лабораторного и аппаратного исследования.
Кроме стандартных анализов, проверяют уровень фракции метгемоглобина (FMetHb) в сыворотке крови. Он присутствует в здоровом организме как продукт метаболизма, в количестве не более 1,0–1,5% от общего гемоглобина (Hb). При отравлениях симптомы появляются при значениях больше 3% FMetHb.
 Принципы лечения острого отравления анилином, следующие:
Принципы лечения острого отравления анилином, следующие:
- внутривенное введение антидота — метиленовый синий, аскорбиновая кислота, тиосульфат натрия;
- инфузионная терапия солевыми растворами;
- диуретики (мочегонные препараты);
- коррекция функции дыхания — в зависимости от показаний перевод на искусственную вентиляцию лёгких;
- методы эфферентной детоксикации — гемодиализ, гемосорбция;
- гипербарическая оксигенация для восстановления транспорта кислорода;
- мониторинг артериального давления, частоты сердечных сокращений, ЭКГ, температуры тела, диуреза, лабораторных анализов.
Интенсивная терапия проводится в условиях отделения анестезиологии-реанимации.
При подозрении на хроническое отравление анилином необходимо обратиться к врачу и пройти обследование. Анализы фракций гемоглобина доступны в амбулаторных условиях.
Последствия отравления
Интоксикация анилином опасна не только в острой, но и хронической форме. При длительном его воздействии на организм человека развиваются:
- осложнения со стороны центральной и периферической нервной системы, печени, почек, селезёнки, сердца, лёгких, желудочно-кишечного тракта;
- нарушения функций зрительного аппарата;
- дерматиты;
- анемия.
Канцерогенность анилина и его соединений для человека не доказана. Такие результаты получены только при исследованиях на лабораторных животных.
Симптомы анилиновой интоксикации неспецифичны. Избежать последствий хронического отравления поможет регулярное прохождение медицинских осмотров, предусмотренное федеральным законодательством.
Профилактика отравлений
Анилин относится к веществам II класса опасности — ГОСТ 12.1.005. Предельно допустимая концентрация (ПДК) в воздухе производственных помещений — 0,1 мг/м3.
Техника безопасности при работе с анилином предусматривает:

- использование средств индивидуальной защиты — костюма, перчаток, маски, очков;
- оборудование производственных помещений приточно-вытяжной вентиляцией;
- регулярное забор анализов воздуха в рабочих зонах;
- запрещение курения и питания в рабочих помещениях;
- соблюдение требований пожарной и взрывоопасности.
При сжигании анилина в воздух попадают токсичные или едкие пары — аммиак, оксиды азота, а также горючие пары, которые тоже могут вызвать отравление.
Работая в домашних условиях с анилиновыми красителями, необходимо следить за самочувствием. При появлении тревожных симптомов важно сразу же проветрить помещение или покинуть его.
Подводим итоги. Анилин — это органическое соединение, нашедшее применение в разных сферах промышленности. В лечебных дозах он входит в состав лекарственных препаратов. История использования анилина неразрывно связана с изучением признаков отравления этим сильнодействующим ядом. Чаще всего он попадает в организм через дыхательные пути. При своевременном прекращении контакта с токсином прогноз заболевания значительно улучшается. Избежать отравления можно, предприняв несложные меры безопасности.
Первая помощь при отравлении химическими веществами
Источник
Анилин – органическое вещество. Впервые его получили в 1826 году. Другие названия – фениламин, аминобензол. Наименование «анилин» произошло от названия растения «индигофера анил», в котором содержится индиго. Раньше фениламин создавался с участием этого вещества. Рассмотрим свойства и применение анилина.

Вещество относится к простейшим ароматическим аминам. Его формула C6H5NH2.
Физические свойства анилина
Ядовитое вещество, пары которого токсичны. Представляет собой маслянистую жидкость, не имеющую цвета. Запах слабый, характерный именно для этого вещества. При его возгорании пламя яркое, коптящее.
Частично растворим в воде (при температуре кипения растворимость 6,4 %). Минерализованная вода понижает его растворимость, за исключением содержания бромидов лития и цезия, а также йодида цезия. Последний, наоборот, повышает растворимость анилина.
При хранении вещество темнеет, особенно быстро это происходит при воздействии воздуха и света. При этом он делается более вязким. Иначе данный процесс называют «аутооксидацией». Окисление может быть замедленно при помощи добавления антиоксидантов – щавелевой кислоты, гидро- и тиосульфата натрия.

Ниже приведены характеристики анилина при нормальном атмосферном давлении:
- температура кипения – 184,4 °С;
- температура плавления/замерзания – минус 5,89 °С;
- плотность при температуре 20 °С – 1,02 г/см куб.;
- температура самовоспламенения на воздухе – 562 °C;
- температура вспышки на воздухе – 79 °C.
Основные области применения анилина
В России вещество в основном применяют для синтеза красителей и лекарственных средств, в текстильной и фармацевтической промышленности. С помощью анилина получают препараты группы сульфамидов, обладающие антибактериальным действием, а также синтезируют заменители сахара.
Существуют и другие области применения аниолина. В химии его используют для получения гидрохинона – вещества, использующегося в косметике, в основном в составе отбеливающих кожу средств. Также вещество применяется в создании взрывчатых веществ, клеев, герметиков.
При помощи анилина замедляется коррозия металлов: его фосфаты добавляют к растворам сильных электролитов, в результате чего ингибируется коррозия углеродистой стали.
Применяют анилин и для повышения антидетонационности топлива (автомобильного, ракетного, авиационного). Октановое число бензина при однопроцентном содержании анилина повышается на 3 единицы и более. Но в чистом виде вещество стараются не использовать, так как при длительном хранении понижается качество бензина с анилином, а также токсичность его газов. Чаще используются производные вещества. В ряде западных государств существуют ограничения на применение анилина в составе топлива.
В мире большая часть получаемого анилина используется в производстве полиуретанов, а также синтетических каучуков, красок, средств от сорняков.
Анилиновые красители
Самой главной сферой применения анилина было и остается производство красителей. Они изготовляются при помощи окисления анилина и его солей.

Первоначально анилиновые краски выпускались только в форме порошка. В СССР им находили применение в быту, реставрируя и переделывая вещи посредством их окраски. Но покрашенные вещи быстро блёкли при попадании солнечного света, краска вымывалась в процессе стирки. В настоящее время анилиновые красители производятся и в форме растворов, причем некоторые производители выпускают концентрированные растворы, которые в отличие от порошков не требуют особой подготовки ткани. Но, несмотря на ощутимый прогресс и улучшение красителей, ткани, покрашенные ими, по-прежнему быстро выгорают на солнце.
Токсичность анилина
Анилин – токсичное вещество. Может угнетать нервную систему, при попадании в кровь вызывает кислородное голодание тканей. Попасть в организм может в виде паров, а также проникнуть через кожу и слизистые оболочки.

Сейчас отравления анилином бывают редко. Опасность это вещество представляет в основном для тех, кто работает с ним. Во избежание попадания токсина в организм нужно соблюдать установленные меры безопасности. При окрашивании дома вещей анилиновыми красителями, в особенности порошковыми, нужно беречь их от детей, проветривать помещение, в котором производится окраска, не глотать вещество, при попадании на части тела немедленно смывать его водой и производить окрашивание в перчатках. Если анилин был случайно проглочен, нужно незамедлительно обращаться к врачу.
Источник
Анилин — это органическое соединение, содержащее ароматическое ядро и аминогруппу, соединенную с ним. Его также иногда называют фениламином или аминобензолом. Представляет собой маслянистую жидкость, не имеющую цвета, но с характерным запахом. Сильно ядовит.
Получение
Анилин — очень полезное промежуточное вещество, поэтому производится он в относительно больших масштабах. Промышленный синтез начинается с бензола. Его нитруют при температуре 60 °C смесью концентрированных серной и азотной кислот. Далее полученный нитробензол восстанавливают водородом при температуре около 250 °C, используя катализаторы. Также может применяться повышенное давление.

В лаборатории восстановление может производится водородом в момент его выделения. Для этого в реакционной смеси проводят взаимодействие металлического цинка или железа с кислотой. Полученный атомарный водород вступает во взаимодействие с нитробензолом.
Получать анилин можно в одну стадию, если проводить взаимодействие бензола со смесью азида натрия и хлорида алюминия. Реакция длится 12 часов. Выход такой реакции составляет 63 %.
Физические свойства
Как уже было отмечено выше, анилин — это бесцветная маслянистая жидкость. При температуре -5,9 °C он замерзает. Кипит при 184,4 °C. Плотность почти как у воды (1,02 г/см3). Анилин растворим в воде, хотя довольно слабо. Зато он смешивается в любых соотношениях с различными органическими растворителями: бензолом, толуолом, ацетоном, диэтиловым эфиром, этанолом и многими другими.
Химические свойства
Химические свойства анилина довольно разнообразны. Например, он проявляет как кислотные, так и основные свойства. Последние обусловлены тем, что аминогруппа может присоединять к себе ион водорода (протон). Отсюда и название этого процесса — протонирование. Благодаря этому анилин может взаимодействовать с кислотами, образуя соли:
C6H5NH2 + HCl → [C6H5NH3]+Cl-
Кислотные свойства объясняются тем, что атомы водорода в аминогруппе легко отщепляются и замещаются другими атомами. Так, анилин может взаимодействовать со щелочными металлами. Реакция с калием идет без катализаторов, с натрием необходимо присутствие катализаторов: меди, никеля, кобальта или солей этих металлов. Идти эта реакция может и с кальцием, но в этом случае необходимо нагревание до 200 °C.

Замещается водород и радикалами. Это происходит при взаимодействии анилина со спиртами. Реакция проводится в кислой среде, так как необходимо протонирование аминогруппы. Температура реакционной смеси должна поддерживаться около 220 °C. Иногда применяется повышенное давление. Конечный продукт содержит моно-, ди- и тризамещенные производные анилина. Поэтому для получения чистого вещества необходимо использовать очистку, например перегонку.

Алкилирование можно также проводить, используя алкилгалогениды. Здесь также может быть получены несколько продуктов.

Анилин может вступать в реакции и по ароматическому ядру. Обычно это реакции электрофильного замещения (нитрование, сульфирование, алкилирование, ацилирование). Аминогруппа активирует бензольное ядро, поэтому новые группы встают в пара-положение. Галогенирование происходит очень легко. В данном случае замещаются все атомы водорода в ядре.
Как видно из уравнений реакций, химические свойства анилина довольно разнообразные. Здесь указаны далеко не все.
Применение
Из-за своих физических и химических свойств, анилин в чистом виде применяется только в лабораториях, как реагент или органический растворитель. В промышленности весь анилин уходит на синтез более сложных и полезных соединений. Например, фосфат анилина применяется как ингибитор (замедлитель) коррозии углеродистых сталей.
Большая доля анилина идет на производство полиизоцианатов, из которых, в свою очередь, получают полиуретаны. Это органический полимер, который используют во многих отраслях промышленности для изготовления эластичных форм, защитных покрытий, лаков, герметиков.
7 % анилина применяется в качестве добавки для полимеров. Это может быть как чистый анилин, так и соединения, полученные из него. Они оказывают роль инициаторов, стабилизаторов, пластификаторов, порообразователей, вулканизаторов или ускорителей полимеризации. Такое разнообразие достигается благодаря специфичным химическим свойствам анилина.
Азотсодержащие органические вещества часто применяют в производстве красителей. Анилин не стал исключением. Из него напрямую синтезируют более 150 различных красителей, еще больше — из его производных. Самые важные из них — это анилиновый черный, пигмент глубоко-черный, нигрозины, индулины и азокрасители.
Токсичность
Анилин — токсичное вещество. Попадая в кровь, он образует соединения, которые вызывают кислородное голодание. Проникать в организм он может также и в виде паров, через кожу или слизистые оболочки. Признаками отравления анилином служат слабость, головокружение, головная боль. При более сильном отравлении возникает тошнота, рвота, а также учащение пульса.
Это вещество оказывает губительное воздействие на нервную систему. При хроническом отравлении может возникать снижение памяти, расстройства сна, а также психические нарушения.
Первая помощь при интоксикациии состоит в том, чтобы убрать источник отравления и омыть пострадавшего теплой водой. Это поможет растворить анилин, который осел на коже пострадавшего. Существуют и специальные антидоты. Их вводят в организм при тяжелых случаях.
Источник
