Метформин побочные действия на почки
В статье приведены результаты исследования влияния метформина на функцию почек у пациентов с сахарным диабетом 2-го типа на инсулинотерапии
Введение
Сахарный диабет (СД) 2-го типа и его почечное микрососудистое осложнение – диабетическая нефропатия (ДН) являются самостоятельными факторами риска развития сердечно-сосудистых катастроф [1]. Несмотря на большое количество исследований, изучающих влияние различных сахароснижающих препаратов на сердечно-сосудистые исходы, метформин пока является единственным среди них, убедительно продемонстрировавшим в крупных эпидемиологических исследованиях способность уменьшать риск развития макрососудистых осложнений СД 2-го типа [2, 3].
Плейотропные сердечно-сосудистые эффекты метформина отчасти обусловлены его способностью уменьшать инсулинорезистентность, избыточный вес, дислипидемию, улучшать реологические свойства крови, ослаблять проявления эндотелиальной дисфункции и оксидативного стресса [4]. Несмотря на то, что описанным нарушениям отводится важная роль и в патогенезе ДН [1, 4], данные о влиянии метформина на почечную функцию при СД 2-го типа не столь однозначны. Так, длительное время применение метформина у пациентов с умеренно сниженной функцией почек (клиренс креатинина < 60 мл/мин) было ограничено из-за необоснованного мнения об увеличении риска развития лактат-ацидоза [5]. В настоящее время уровнем официально допустимого клиренса креатинина при первичном назначении препарата является ≥ 45 мл/мин [6].
Несмотря на то, что результаты ряда крупных клинических исследований не показали значимого влияния метформина на проявления ДН при назначении в качестве монотерапии СД 2-го типа в дебюте заболевания [7–9], в последнее десятилетие стали появляться экспериментальные доказательства возможного наличия у метформина нефропротективного потенциала за счет уменьшения процессов воспаления, а также глико- и липооксидации в почечных структурах [10–12]. Учитывая высокую частоту использования инсулинотерапии при СД 2-го типа [1, 13], важно оценить эффекты комбинации инсулинотерапии и метформина на почечную функцию, в т. ч. с использованием показателей, которые мало зависят от изменения массы тела, ожидаемого на терапии метформином [2–4, 7–9].
Материал и методы исследования
Исследование было одобрено локальным этическим комитетом, проводилось в соответствии с Хельсинкской декларацией. Все участники подписывали информированное согласие.
В исследование включались мужчины и женщины европеоидной расы в возрасте от 45 до 70 лет с СД 2-го типа, получающие терапию инсулином (в базис-болюсном или базал-плюс режиме) в суточной дозе до 0,5 ед/кг и с уровнем гликированного гемоглобина (HbA1c), липидов крови и цифрами АД не выше 10% от индивидуальных целевых значений, с отсутствием тяжелых микрососудистых осложнений заболевания, СКФ ≥ 60 мл/мин/1,73 м2 и альбуминурией < 200 мг/л.
Критериями невключения в исследование были: гиперчувствительность к компонентам, входящим в состав таблетки метформина, лактат-ацидоз в анамнезе, выраженная печеночная патология, любые острые состояния, первично-почечная патология недиабетического генеза, анемия средней и тяжелой степени, применение нефротоксичных препаратов менее чем за 6 мес. до начала исследования, регулярный прием НПВП, тяжелая сопутствующая сердечно-сосудистая патология, системные и онкологические заболевания, терапия иммуносупрессорами.
Участникам исследования были даны рекомендации по соблюдению прежнего водно-солевого режима и режима физической активности. Клиническое обследование пациентов включало анализ жалоб и истории заболевания, осмотр, измерение АД, тощакового и постпрандиального уровня глюкозы крови, расчет индекса массы тела (ИМТ).
В исследование было включено 46 пациентов с СД 2-го типа, рандомизированных в соотношении 1:1 получать дополнительно к инсулину терапию метформином в дозе 1500 мг/сут или продолжать монотерапию инсулином в течение последующих 6 мес.
Ежемесячно осуществлялся телефонный опрос пациентов, при необходимости проводилась коррекция доз и режима введения инсулина. В течение этого времени была оценена динамика показателей углеводного обмена: тощаковая и постпрандиальная гликемия, HbA1c (с использованием ВЭЖХ на анализаторе Bio Rad d10 (США)). Фиксировались частота развития гипогликемических эпизодов (симптоматически и/или при снижении гликемии <3,9 ммоль/л) и изменение дозы инсулина. Оценивалась динамика показателей липидного обмена (общий холестерин, триглицериды), цистатин С и креатинин сыворотки, уровни альбумина и креатинина в утренней порции мочи (с расчетом альбумин-креатининового соотношения (АКС)), определяемых с использованием реактивов и анализатора Cobas Integra 400 plus фирмы Rochе (Германия). На основании полученных значений рассчитывались показатели рСКФ по креатинину (рСКФкр) по формуле Кокрофта – Голта [6, 14], рСКФкр и рСКФ по цистатину С (рСКФцис) по формуле CKD-EPI [15].
Статистическая обработка полученных данных проводилась с использованием пакетов статистических программ Statistica 6.0 (StatSoft, США) и SPSS 20.0 (SPSS Inc., США) с использованием непараметрических тестов (Уилкоксона, Манна – Уитни); для сравнения распределения качественных признаков использовался критерий χ2; связь динамики показателей оценивалась с помощью коэффициента ранговой корреляции Спирмена. Значимыми считались различия при уровне р < 0,05.
Результаты и их обсуждение
43 пациента завершили исследование (21 – в группе терапии инсулином (ИГ) и 22 – в группе комбинированной терапии инсулином и метформином (МИГ)).
Клиническая характеристика сравниваемых групп
Сравниваемые группы были сопоставимы по половозрастным характеристикам и антропометрическим показателям: в группе ИГ средний возраст пациентов, 42,9% которых являлись мужчинами, составил 60,05±6,13 года, ИМТ – 31,6±4,3 кг/м2, в группе МИГ – 45,5% (р = 0,86), 60,14±5,95 года (р = 0,75) и 32,0±3,1 кг/м2 (р = 0,59), соответственно. Стаж СД 2-го типа c момента выявления заболевания в обеих группах в среднем составил 10 лет (в ИГ – 10,52±4,84 года, в МИГ – 9,7±3,6 года, р = 0,35). Абсолютное большинство пациентов, у которых была артериальная гипертензия (ее распространенность составила около 70% в обеих сравниваемых группах), получали различные группы блокаторов ренин-ангиотензин-альдостероновой системы (в группе ИГ – 76,2% пациентов, в группе комбинированной терапии – 63,6%, р = 0,37). Все пациенты с ДН в стадии альбуминурии (ХБП, стадия А2), распространенность которой в группе терапии инсулином была несколько выше (в ИГ – 57,1%, в МИГ – 42,9%, р = 0,88), получали нефропротективную терапию иАПФ или сартанами. Из других хронических осложнений СД 2-го типа наиболее часто выявлялась диабетическая дистальная полинейропатия нижних конечностей (в ИГ – у 81,0%, в МИГ – у 77,3% пациентов, р = 0,77). Непролиферативная стадия диабетической ретинопатии была зарегистрирована в 38,1% случаев в группе ИГ и в 31,8% – в группе МИГ, р=0,69. Сердечно-сосудистые события в анамнезе, такие как стабильная стенокардия до II функционального класса, более 6 мес. назад перенесенные ОКС, инфаркт миокарда, ОНМК, а также атеросклероз магистральных артерий без гемодинамически значимых стенозов и т. п., также несколько чаще выявлялись в группе пациентов, рандомизированных продолжать инсулинотерапию (52,4% против 45,5% в группе комбинированного лечения, р = 0,65). Почти все пациенты с анамнезом сердечно-сосудистых заболеваний получали терапию статинами. Курильщики также преобладали в группе ИГ (33,3%) по сравнению с группой МИГ (22,7%, р = 0,44).
Полученные данные в целом не противоречат результатам проводимых скрининговых исследований в РФ, свидетельствующих о наибольшей распространенности у пациентов с СД 2-го типа диабетической нейропатии, причем уже на стадии нормальной экскреции альбумина с мочой, и высоком проценте выявления стадии микроальбуминурии (до 40%) при длительности СД 2-го типа не менее 10 лет [1]. Стоит также отметить, что большинство пациентов с альбуминурией > 20 мг/л имели микрососудистые изменения на глазном дне, что косвенно свидетельствует о диабетическом генезе почечной дисфункции, подтверждая системность поражения микроциркуляторного русла при СД 2-го типа [1].
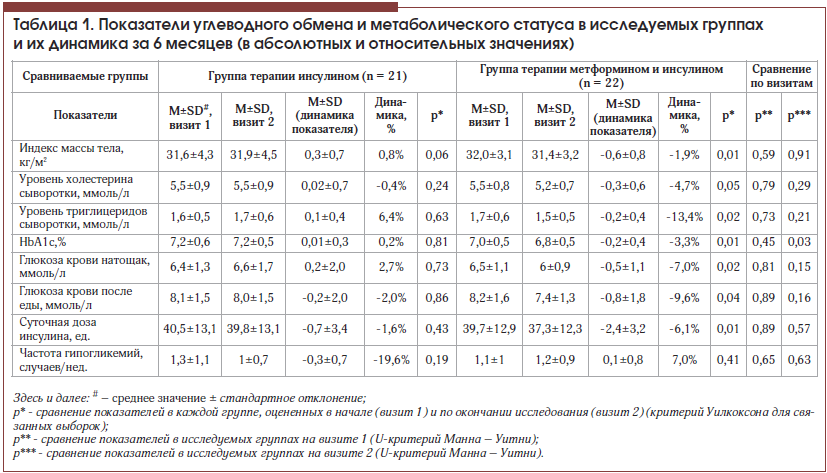
Динамика показателей компенсации углеводного обмена и метаболического статуса
Сравниваемые группы были сопоставимы по основным параметрам, характеризующим метаболический статус и состояние углеводного обмена (табл. 1). В обеих группах более низкие показатели общего холестерина (ОХ) и триглицеридов (ТГ) отмечались у пациентов с анамнезом сердечно-сосудистой патологии, поскольку данная когорта имела более жесткие критерии целевых показателей липидограммы и получала липидснижающую терапию.

В ходе исследования у пациентов, рандомизированных в группу продолжения прежней терапии инсулином (ИГ), не произошло значимого изменения оцениваемых показателей. Тем не менее коррекция режима введения инсулина даже в пределах прежней дозы без существенного ее изменения (снижение на 1,6±7,8%, р = 0,43) привела к существенному сокращению частоты гипогликемических эпизодов почти на 20%, которое, однако, оказалось незначимым. Эти данные свидетельствуют о важности частого взаимодействия эндокринолога и пациента с СД 2-го типа даже при подобранной дозе инсулина, а также подтверждают тот факт, что режим введения инсулинотерапии (распределение доз в течение суток, необходимость выдерживания разных по длительности интервалов перед едой после введения коротких/ультракоротких инсулинов и в зависимости от уровня гликемии, рекомендации по частой смене мест введения инсулина и т. п.), а не только доза инсулина способствуют достижению компенсации заболевания.
В группе пациентов, которым к инсулинотерапии был добавлен метформин (МИГ), произошло значимое снижение массы тела, уровня ТГ, показателей гликемии и гликированного гемоглобина при одновременном уменьшении потребности в инсулине (табл. 1). Кроме того, близким к значимому оказалось снижение уровня ОХ. Полученные данные подтверждают известные позитивные свойства препарата в отношении преодоления инсулинорезистентности, абдоминального ожирения и дислипидемии, продемонстрированные в клинической практике [3, 8, 9, 16–18].
Динамика показателей почечной функции
Результаты исследования функции почек и динамики АД приведены в таблице 2. Сравниваемые группы были сопоставимы по уровням значений основных показателей почечной функции, оцениваемых в рутинной диабетологической практике. Между тем внутри группы обращала на себя внимание значимая разница, выявленная при определении СКФ, рассчитанной различными методиками – по креатинину и цистатину С. Это согласуется с имеющимися литературными данными, поскольку уровень цистатина С по сравнению с уровнем креатинина является более надежным биохимическим индикатором нарушения фильтрационной способности почек, значимо не зависящим от расы, поло-возрастных характеристик, объема мышечной массы, физической активности и особенностей питания [19].
В группе терапии инсулином в течение 6 мес. оцениваемые показатели значимо не изменились (табл. 2). Вместе с тем в группе комбинированного лечения за 6 мес. произошло близкое к значимому повышение уровня креатинина на 2,3±5,9% (р = 0,07), что нашло отражение в значимом снижении рСКФкр, рассчитанной по формуле Кокрофта – Голта (-4,3±8,5%, р = 0,024). Однако стоит напомнить, что в этой группе произошло значимое снижение показателя массы тела (на -1,8±2,3 кг, р=0,0028), входящего в расчетную формулу, предложенную Д. Кокрофтом и Г. Голтом в 1976 г. [14]. Это подтвердил и корреляционный анализ, продемонстрировавший четкую связь динамики рСКФкр (по Кокрофту – Голту) и динамики массы тела (r=0,61, p=0,0068). К настоящему моменту убедительно продемонстрировано, что данная формула наиболее точно коррелирует с клиренсовыми методами определения СКФ только в диапазоне сниженных значений почечной функции [14, 19]. Примечательно, что изменение СКФ не зарегистрировано при использовании считающейся более точной формулы CKD-EPI рСКФцис [15]. Определение уровня цистатина С особенно целесообразно использовать при умеренно сниженных значениях СКФ (от 45 до 60 мл/мин), когда отсутствуют другие признаки поражения почек [19].
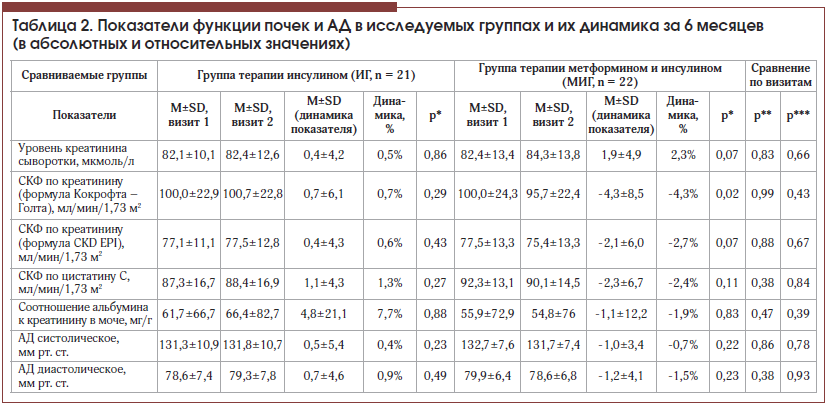
В нашем исследовании не выявлено значимого влияния добавления терапии метформином на рСКФ по цистатину С и альбумин-креатининовое соотношение. Кроме того, незначимым оказалось влияние препарата на динамику как систолического, так и диастолического АД за 6 мес. наблюдения, однако оба этих показателя снизились только в группе комбинированной терапии.
В ряде крупных исследований также оценивался эффект назначения метформина на показатели почечной функции. Так, анализ результатов 5-летнего наблюдения за пациентами с СД 2-го типа с умеренным ожирением, участвующими в исследовании ADOPT, 1454 из которых были рандомизированы получать в качестве стартовой терапии метформин в дозе 2000 мг/сут, не показал значимой способности препарата, по сравнению с терапией росиглитазоном, замедлять снижение СКФ (рассчитанной по формуле MDRD) или нарастание альбуминурии, которая на момент начала исследования выявлялась почти в 20% случаев [8]. Схожие данные получены в ходе анализа 10-летнего наблюдения пациентов, участвовавших в UKPDS: не было выявлено значимого влияния препарата на уровень креатинина и альбумин-креатининовое соотношение по сравнению с монодиетотерапией [7]. Тем не менее в этих исследованиях не наблюдалось и ухудшение почечной функции на терапии метформином. В ретроспективном анализе данных более 60 тыс. пациентов, включенных в американскую базу данных ветеранов, продемонстрировано, что терапия метформином в качестве стартового сахароснижающего препарата, по сравнению с препаратами группы сульфонилмочевины, не ассоциирована с повышенными рисками снижения СКФ и/или возникновения терминальной стадии ХПН [9]. А в небольшом по объему выборки исследовании Amador – Licona et al. даже была показана способность метформина, назначенного в субмаксимальной дозе на 12 нед. после приема глибенкламида, значимо снижать альбуминурию [20]. Исследователи связали наблюдаемый эффект с позитивным влиянием препарата на показатели углеводного обмена, метаболический статус и со снижением АД, отмеченным в группе терапии метформином.
В нашей работе также показано положительное влияние добавления метформина в отношении веса, показателей гликемии и липидограммы. Но, в отличие от вышеупомянутых исследований, препарат применяли пациенты с СД 2-го типа на инсулинотерапии, многим из которых она назначалась после длительного стажа приема пероральных сахароснижающих препаратов или на фоне возникновения острых сердечно-сосудистых событий (инфаркт миокарда, ОНМК и т. п.). В схожем по дизайну исследовании Dе Jager et al. с участием 353 пациентов с СД 2-го типа на инсулинотерапии, рандомизированных продолжать ее или получать дополнительно метформин в дозе 2550 мг/сут в течение 4 мес., исследовалось влияние препарата на маркеры эндотелиальной дисфункции и системного воспаления [21]. Обращало на себя внимание, что несмотря на снижение в группе комбинированного лечения показателей гликемии, улучшение в липидограмме и снижение потребности в инсулине, было выявлено близкое к значимому повышение альбуминурии за период наблюдения (на 21%, р = 0,06). Однако, в отличие от нашей работы, в данное исследование включались пациенты с неудовлетворительным контролем гликемии (тощаковая гликемия > 10 ммоль/л), имеющие плохо скорректированную артериальную гипертензию (АД > 160/85 мм рт. ст.) при низком проценте приема адекватной антигипертензивной терапии, что само по себе могло способствовать прогрессии альбуминурии [21]. Кроме того, в данных исследованиях не уточняется уровень гемоглобина и эритроцитов. Вместе с тем известно, что терапия метформином в субмаксимальных дозах ассоциирована с возникновением дефицита витамина В12, что может приводить к возникновению анемии [22]. Между тем в клинических исследованиях убедительно было продемонстрировано, что анемия у пациентов с диабетическим поражением почек тесно связана с дальнейшим прогрессированием почечной дисфункции [1, 23].
Выполненное исследование имеет ряд ограничений, связанных с его непродолжительностью, отсутствием перекрестного дизайна и оценки показателей расширенной липидограммы, а также с невозможностью учета влияния вида получаемого инсулина из-за немногочисленности групп пациентов. Кроме того, поскольку в ряде экспериментальных работ была показана способность метформина уменьшать повреждение эпителия почечных канальцев [24, 25], целесообразным могло бы являться включение в работу лабораторных показателей, помимо рутинных маркеров оценивающих канальцевую дисфункцию.
Выводы:
1) добавление метформина в дозе 1500 мг на 6 мес. пациентам с СД 2-го типа на инсулинотерапии без выраженной почечной дисфункции не оказывает значимого влияния на рутинные почечные маркеры и уровень АД;
2) добавление метформина к инсулинотерапии у пациентов с близкими к целевым показателями компенсации позволяет снизить потребность в инсулине при одновременном улучшении как уровня гликемии, так и других метаболических параметров.
Источник
Действующее вещество
– метформина гидрохлорид (metformin)
Состав и форма выпуска препарата
Таблетки, покрытые пленочной оболочкой белого или почти белого цвета, овальной формы, двояковыпуклые, с риской на одной стороне и тиснением символа “f ” на другой.
| 1 таб. | |
| метформина гидрохлорид | 1000 мг |
Вспомогательные вещества: повидон (коллидон 90 F) – 36 мг, гипролоза низкозамещенная – 60 мг, глицерил дибегенат – 98 мг, магния стеарат – 6 мг.
Состав оболочки: гипромеллоза – 14.82 мг, титана диоксид – 11.4 мг, полидекстроза – 5.7 мг, тальк – 3.8 мг, макрогол 3350 – 2.28 мг.
10 шт. – упаковки ячейковые контурные (3) – пачки картонные.
10 шт. – упаковки ячейковые контурные (6) – пачки картонные.
10 шт. – упаковки ячейковые контурные (9) – пачки картонные.
10 шт. – упаковки ячейковые контурные (12) – пачки картонные.
15 шт. – упаковки ячейковые контурные (2) – пачки картонные.
15 шт. – упаковки ячейковые контурные (4) – пачки картонные.
15 шт. – упаковки ячейковые контурные (6) – пачки картонные.
15 шт. – упаковки ячейковые контурные (8) – пачки картонные.
30 шт. – флаконы (1) – пачки картонные.
60 шт. – флаконы (1) – пачки картонные.
30 шт. – банки (1) – пачки картонные.
60 шт. – банки (1) – пачки картонные.
Фармакологическое действие
Пероральное гипогликемическое средство из группы бигуанидов (диметилбигуанид). Механизм действия метформина связан с его способностью подавлять глюконеогенез, а также образование свободных жирных кислот и окисление жиров. Повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками. Метформин не влияет на количество инсулина в крови, но изменяет его фармакодинамику за счет снижения соотношения связанного инсулина к свободному и повышения соотношения инсулина к проинсулину.
Метформин стимулирует синтез гликогена, воздействуя на гликогенсинтетазу. Увеличивает транспортную емкость всех типов мембранных переносчиков глюкозы. Задерживает всасывание глюкозы в кишечнике.
Снижает уровень триглицеридов, ЛПНП, ЛПОНП. Метформин улучшает фибринолитические свойства крови за счет подавления ингибитора активатора плазминогена тканевого типа.
На фоне приема метформина масса тела пациента либо остается стабильной, либо умеренно снижается.
Фармакокинетика
После приема внутрь метформин медленно и неполностью абсорбируется из ЖКТ. Cmax в плазме достигается примерно через 2.5 ч. При однократной дозе 500 мг абсолютная биодоступность составляет 50-60%. При одновременном приеме пищи абсорбция метформина снижается и задерживается.
Метформин быстро распределяется в ткани организма. Практически не связывается с белками плазмы. Накапливается в слюнных железах, печени и почках.
Выводится почками в неизмененном виде. T1/2 из плазмы составляет 2-6 ч.
При нарушениях функции почек возможна кумуляция метформина.
Показания
Сахарный диабет 2 типа (инсулиннезависимый) при неэффективности диетотерапии и физической нагрузки, у пациентов с ожирением: у взрослых – в качестве монотерапии или в комбинации с другими пероральными гипогликемическими средствами или с инсулином; у детей в возрасте 10 лет и старше – в качестве монотерапии или в комбинации с инсулином.
Противопоказания
Острый или хронический метаболический ацидоз, диабетический кетоацидоз, диабетическая прекома и кома; почечная недостаточность, нарушение функции почек (КК<60 мл/мин); обезвоживание организма, тяжелая инфекция, гипогликемический шок, которые могут привести к нарушению функции почек; клинически выраженные симптомы острых и хронических заболеваний, которые могут привести к развитию тканевой гипоксии (в т.ч. сердечная недостаточность, острый инфаркт миокарда, дыхательная недостаточность); применение контрастных йодсодержащих веществ для внутрисосудистого введения (в т.ч. при проведении в/в урографии, в/в холангиографии, ангиографии, КТ); острая алкогольная интоксикация, хронический алкоголизм; повышенная чувствительность к метформину.
Дозировка
Принимают внутрь, во время или после приема пищи.
Доза и кратность приема зависит от применяемой лекарственной формы.
При монотерапии начальная разовая доза для взрослых – 500 мг, в зависимости от применяемой лекарственной формы кратность приема – 1-3 раза/сут. Возможно применение по 850 мг 1-2 раза/сут. При необходимости дозу постепенно повышают с интервалом 1 нед. до 2-3 г/сут.
При монотерапии для детей в возрасте 10 лет и старше начальная доза составляет 500 мг или 850 1 раз/сут или 500 мг 2 раза/сут. При необходимости, с интервалом не менее 1 нед., доза может быть увеличена максимум до 2 г/сут в 2-3 приема.
Через 10-15 дней дозу необходимо скорректировать на основании результатов определения глюкозы в крови.
При комбинированной терапии с инсулином начальная доза метформина составляет 500-850 мг 2-3 раза/сут. Дозу инсулина подбирают на основании результатов определения глюкозы в крови.
Побочные действия
Со стороны пищеварительной системы: возможны (обычно в начале лечения) тошнота, рвота, диарея, метеоризм, чувство дискомфорта в животе; в единичных случаях – нарушение показателей функции печени, гепатит (исчезают после прекращения лечения).
Со стороны обмена веществ: очень редко – лактат-ацидоз (требуется прекращение лечения).
Со стороны системы кроветворения: очень редко – нарушение всасывания витамина B12.
Профиль побочных реакций у детей в возрасте 10 лет и старше такой же, как у взрослых.
Лекарственное взаимодействие
При одновременном применении с производными сульфонилмочевины, акарбозой, инсулином, салицилатами, ингибиторами МАО, окситетрациклином, ингибиторами АПФ, с клофибратом, циклофосфамидом возможно усиление гипогликемического действия метформина.
При одновременном применении с ГКС, гормональными контрацептивами для приема внутрь, даназолом, эпинефрином, глюкагоном, гормонами щитовидной железы, производными фенотиазина, тиазидными диуретиками, производными никотиновой кислоты возможно уменьшение гипогликемического действия метформина.
У пациентов, получающих метформин, применение йодсодержащих контрастных веществ с целью проведения диагностических исследований (в т.ч. в/в урографии, в/в холангиографии, ангиографии, КТ) повышает риск развития острого нарушения функции почек и лактат-ацидоза. Данные комбинации противопоказаны.
Бета2-адреномиметики в виде инъекций повышают концентрацию глюкозы в крови вследствие стимуляции β2-адренорецепторов. В этом случае необходим контроль концентрации глюкозы в крови. При необходимости рекомендуется назначить инсулин.
Одновременный прием циметидина может усилить риск развития лактат-ацидоза.
Одновременный прием “петлевых” диуретиков может привести к развитию лактат-ацидоза из-за возможной функциональной почечной недостаточности.
Про одновременном приеме с этанолом повышается риск развития лактат-ацидоза.
Нифедипин повышает абсорбцию и Cmax метформина.
Катионные лекарственные средства (амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ранитидин, триамтерен, триметоприм и ванкомицин), секретирующиеся в почечных канальцах, конкурируют с метформином за канальцевые транспортные системы и могут приводить к увеличению его Cmax.
Особые указания
Не рекомендуется применение при острых инфекциях, обострении хронических инфекционно-воспалительных заболеваний, травмах, острых хирургических заболеваниях, опасности дегидратации.
Не применяют перед хирургическими операциями и в течение 2 дней после их проведения.
С осторожностью следует применять метформин у пациентов пожилого возраста и лиц, выполняющих тяжелую физическую работу, что связано с повышенным риском развития молочнокислого ацидоза. У пациентов старческого возраста часто наблюдается бессимптомное нарушение функции почек. Особая осторожность требуется, если нарушение функции почек спровоцировано приемом антигипертензивных препаратов или диуретиков, а также НПВС.
Если во время лечения у пациента появились мышечные судороги, нарушение пищеварения (боли в животе) и выраженная астения, то следует иметь в виду, что эти симптомы могут свидетельствовать о начале развития лактацидоза.
В период лечения необходимо контролировать функцию почек; определение содержания лактата в плазме следует проводить не реже 2 раз в год, а также при появлении миалгии.
При применении метформина в виде монотерапии в соответствии с режимом дозирования гипогликемия, как правило, не возникает. Однако при комбинации с инсулином или с производными сульфонилмочевины имеется риск развития гипогликемии. В таких случаях необходим особо тщательный контроль концентрации глюкозы в крови.
В период лечения пациентам следует избегать употребления алкоголя из-за риска развития лактат-ацидоза.
В доклинических исследованиях показано, что метформин не обладает канцерогенным потенциалом.
Беременность и лактация
Адекватных и строго контролируемых исследований безопасности применения метформина при беременности не проводилось. Применение при беременности возможно в случаях крайней необходимости, когда ожидаемая польза терапии для матери превышает возможный риск для плода. Метформин проникает через плацентарный барьер.
Метформин в небольших количествах выделяется с грудным молоком, при этом концентрация метформина в грудном молоке может составлять 1/3 от концентрации в плазме матери. Побочные эффекты у новорожденных при грудном вскармливании на фоне приема метформина не наблюдались. Однако в связи с ограниченным количеством данных, применение в период грудного вскармливания не рекомендовано. Решение о прекращении грудного вскармливания следует принимать с учетом пользы грудного вскармливания и потенциального риска возникновения побочных эффектов у ребенка.
В доклинических исследованиях показано, что метформин не оказывает тератогенного действия в дозах, которые в 2-3 раза превышают терапевтические дозы, применяющиеся у человека. Метформин не обладает мутагенным потенциалом, не оказывает влияния на фертильность.
При нарушениях функции почек
Противопоказан при выраженных нарушениях функции почек.
При нарушениях функции печени
Противопоказан при выраженных нарушениях функции печени.
Применение в пожилом возрасте
Не рекомендуется применять метформин у пациентов старше 60 лет, что связано с повышенным риском развития молочнокислого ацидоза.
Описание препарата МЕТФОРМИН основано на официально утвержденной инструкции по применению и утверждено компанией–производителем.
Предоставленная информация о ценах на препараты не является предложением о продаже или покупке товара. Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в соответствии со статьей 55 ФЗ «Об обращении лекарственных средств».
Обнаружили ошибку? Выделите ее и нажмите Ctrl+Enter.
Источник
