Противопоказания к лучевой терапии опухолей мозга
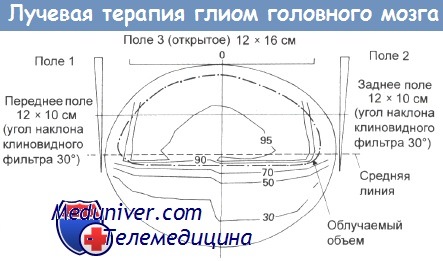
Схема лучевой терапии опухоли головного мозга – Европейские рекомендации
Лучевая терапия — лечение заболеваний с использованием ионизирующего излучения. Как правило, применяется при злокачественных заболеваниях, а также при некоторых доброкачественных (например, при макроаденомах гипофиза). В большинстве случаев лучевая терапия опухолей головного мозга проводится в послеоперационном периоде, методом внешнего облучения рентгеновскими лучами. Также используется ряд других методов, таких как интаоперационная лучевая терапия, корпускулярная и брахитерапия. Значение лучевой терапии во многом зависит от радиочувствительности опухоли.
Возможно лечение (например, при медуллобластомах, герминоклеточных опухолях) или продление жизни (например, при глиомах). Цель заключается в обеспечении максимальной или лечебной дозы для опухоли и минимизации повреждения нормальной ткани.
а) Механизм действия. Лучевая терапия проводится избирательно путем концентрации высокой дозы излучения в области опухоли, при этом учитываются различия в резистентности нормальных и раковых тканей. Облучение повреждает ДНК, которая в свою очередь может восстановиться или привести к гибели клеток с помощью различных механизмов. Осознанное управление молекулярными последствиями облучения приводят к ощутимому улучшению результатов.
Чтобы воспользоваться разницей в восстановлении и кинетическом росте в ответ на облучение, суммарная доза делится на малые дозы или «фракции». В принципе при большем количестве фракций можно достигнуть большего эффекта. Таким образом, радикальное лечение сводится к 30 или более фракциям, в то время как паллиативное лечение включает значительно меньше.
б) Стандартное базовое оснащение. Облучение центральной нервной системы (ЦНС) должно выполняться на линейном ускорителе с энергией 4-6 MV. Он должен иметь возможность для структурирования луча и модуляции интенсивности лучевой терапии (МИЛТ). Должны быть доступны современные средства планирования лучевой терапии, основанные на КТ с модулем имитации и проверки луча.
В основном лучевая терапия проводится в размере одной фракции в 1,8-2,0 Гр в день, пять дней в неделю. Для быстро растущих опухолей большее теоретическое преимущество дает ускоренная терапия (больше, чем одна фракция в день). Кроме того, лучевая нагрузка в низких дозах позволяет дать более высокую суммарную дозу с меньшим воздействием на неизмененные ткани (гиперфракционированая лучевая терапия) с лучшим воздействием на опухоль. Это может быть эффективно при некоторых опухолях у детей. У взрослых не было выявлено преимуществ ни ускоренного, ни гиперфракционированого облучения.
в) Новейшие разработки:
1. Конформная лучевая терапия. Конформная лучевая терапия подразумевает формирование пучка по размеру и контуру опухоли. Это достигается с помощью (микро) многолепесткового коллиматора или блоков литого свинца.
2. Модуляции интенсивности лучевой терапии. Обычно интенсивность дозы облучения по ходу пучка одинакова. При использовании нескольких пучков с неоднородными (с модуляцией интенсивности) профилями можно сформировать единую дозу в очень сложной (даже вогнутой) области. Это имеет свои преимущества при работе рядом с чувствительными или жизненно важными структурами или когда желательно неоднородное распределение дозы.
3. Стереотаксическая радиохирургия/лучевая терапия. Стереотаксис в лучевой терапии означает лечение поражений, локализованных по отношению к внешней системе координат. При адекватной фиксации пациента стереотаксическое излучение может быть доставлено с точностью менее чем 1 мм. Используя эту методику, можно вывести жизненно важные структуры из пучка. Стереотаксическая радиохирургия (СРХ) подразумевает однократное применение абляционной дозы радиации.
4. Чувствительность к облучению. Было опробовано множество веществ, которые теоретически должны повышать чувствительность опухолевой ткани к излучению. К ним относятся сенсибилизаторы, действующие на субклеточном уровне, такие как IUdR и мизонидазол. Ни один из них не оказался эффективным.

Облучение глиомы коры мозга внешним пучком.
Трехпольное облучение всего полушария мозга. Облучаемый объем показан пунктирной линией.
г) Стандартные подходы к лучевой терапии:
1. Глиомы высокой степени злокачественности. Лучевая терапия увеличивает выживаемость пациентов с недавно диагностированной глиомой высокой степени злокачественности (ГВСЗ). Для оптимизации лечения таких больных учитываются такие прогностические факторы, как возраст, общее состояние, точное гистологическое заключение и, в меньшей степени, размер опухоли и резектабельность. Пациенты с большими шансами на эффективность терапии должны проходить максимальное облучение, в то время как при плохом прогнозе можно дать короткий курс лучевой терапии или вообще его не проводить.
Лечение должно быть проведено сразу же после операции. Высокие дозы излучения локализуют в области резекции с добавлением около 2 см от ее края. Облучение большого объема мозга без необходимости больше не считается необходимой. Резекция опухоли может улучшить устойчивость к радиации и снизить потребность в стероидах, которые часто приходится назначать при лучевой терапии.
Максимальное стандартное лечение составляет 56-66 Гр в течение 5-7 недель. Нет подтверждения, что увеличение интенсивности лечения с помощью интерстициальной лучевой терапии, стереотаксической радиохирургии или с помощью альтернативных схем фракционирования улучшает результаты.
Пациентам с неблагоприятным прогнозом может быть предложен короткий курс облучения (например, 30 Гр за шесть фракций).
Было установлено, что прием темозоломида во время и после лучевой терапии улучшает выживаемость у пациентов с глиобластомой. В этом исследовании двухлетняя выживаемость увеличилась с 10 до 26% с улучшением «времени до прогрессирования» без ущерба для качества жизни. У пациентов с хорошим статусом, перенесших удаление опухоли, лучевая терапия наиболее эффективна. Этот сопутствующий/адъювантный режим сейчас принят в качестве стандарта лечения пациентов с глиобластомой во многих странах.
2. Астроцитомы низкой степени злокачественности. По общему опыту, лечение может вызвать регресс глиом низкой степени злокачественности и улучшить клиническое состояние. Тем не менее, ее роль менее ясна, чем при ГВСЗ. По данным крупномасштабного исследования EORTC и RTOG было установлено, что лучевая терапия не улучшает выживание, но увеличивает время до прогрессирования опухоли. Средняя доза (45 Гр) является столь же эффективной, как и более высокие дозы (60 Гр). Кроме того, выяснилось, что факторы риска являются прогностическими для пациентов, способных выиграть от такого лечения.
Пациенты с хорошим прогностическим показателем (удовлетворительное состояние, возраст < 50, размер опухоли < 6 см, опухоли не связанные со средней линией) после первоначального диагноза могут находиться под наблюдением. Когда планируется лучевая терапия, зона облучения должна включать в себя всю область опухоли, плюс 1-2 см по краю. Общая доза облучения должна быть не более 54 Гр (обычно 50 Гр), не более 1,8 Гр за фракцию.
3. Опухоли, обладающие большим потенциалом метастатазирования. Некоторые опухоли распространяются с током спинномозговой жидкости (например, ПНЭО, некоторые герминоклеточные опухоли). Для них может быть необходимо облучение и спинного мозга. Дозы облучения должны быть равномерно распределены по всей поверхности оболочек и их содержимого с увеличением дозы в областях первичной опухоли и скопления метастазов.
Планирование должно осуществляться с помощью КТ и настроено на максимальную протекцию, чтобы снизить риск повреждения жизненно важных структур и отдаленных осложнений. Обычно проводится параллельное облучение полей мозга и нижней части позвоночника с совмещением одиночного заднего поля позвоночника. Стандартное лечение медуллобластомы без химиотерапии включает облучение всего спинного и головного мозга в дозе 30-35 Гр и опухоли в дозе 55 Гр. Доза может быть снижена при сочетании с химиотерапией. Совершенствование лечения является задачей современных исследований.
4. Радиотерапия доброкачественных опухолей. Некоторые доброкачественные опухоли чувствительны к лучевой терапии (менингиома, аденома гипофиза, краниофарингиома). Долгосрочные перспективы выживания хороши, поэтому, при наведении и дозировке необходима особая точность, для чего в соответствующих случаях может использоваться стереотаксическое наведение IMRT и некомпланарное планирование. Минимальная эффективная фракционная доза составляет не менее 2 Гр. В некоторых случаях может быть использована СРХ.
5. Метастазы. Лучевая терапия является одним из основных методов в лечении метастазов головного мозга, но, возможно, ею отчасти злоупотребляют. Отбор пациентов должн быть основан на принятой схеме классификации. У пациентов с множественными метастазами и тяжелым соматическим статусом, вероятно, преимуществ от лечения не достигается. Молодые пациенты с лучшим состоянием должны получать короткие курсы облучения (20 Гр за пять фракций в течение одной недели).
Пациенты с солитарными (или несколькими) метастазами в головном мозгу, особенно если контролируется системное заболевание, оцениваются в отношении возможности радикального лечение. Хирургия и стереотаксическая радиохирургия (СРХ) в этом случае имеют схожую эффективность. Облучение всего головного мозга снижает риск рецидива и является полезным дополнением.
д) Отдаленные последствия лучевой терапии. Здоровая ткань мозга, прилегающая к опухоли, неизбежно подвергается риску повреждения. Наиболее важные изменения происходят достаточно поздно после облучения (от 6 месяцев до 10 лет) и включают изменения белого вещества, повреждение сосудов, нейронов, глиоз и кальцификации. Клинические проявления могут варьировать от незначительного ухудшения когнитивных функций до грубого неврологического дефицита. Риск после тщательно взвешенного и дозированного облучения, очевидно, преувеличивается.
У пациентов с глиомами низкой степени злокачественности отдаленные последствия могут быть умеренными по сравнению со случаями дефицита перед облучением. У пациентов с предшетвующими нарушениями когнитивных функций после лучевой терапии может наблюдаться их улучшение.
е) Клинические и научные разработки лучевой терапии опухоли головного мозга:
1. Протоны. В протонном пучке наибольшее количество энергии выделяется на последних нескольких миллиметрах пути, известном как «максимум Брэгга». Это свойство можно использовать для доставки в опухоли больших доз облучения, в том числе находящихся в непосредственной близости от жизненно важных структур. Наиболее распространенной областью применения в ЦНС являются хордомы ската черепа и другие опухоли основания черепа. Однако данная технология очень дорога и доступна в очень немногих центрах.
2. Брахитерапия. Брахитерапия основана на использовании временных имплантов с высокой активностью (125I) и применялась при глиомах высокой степени злокачественности при рецидиве или первичном лечении. Однако результаты не подтвердили эффективность брахитерапии. Импланты также применялись для лечения глиом низкой степени злокачественности, а иридиевая проволока в качестве паллиативного средства при глиобластоме.
3. Терапия методом захвата нейтронов бором. Терапия методом захвата нейтронов бором заключается в захвате и взаимодействии нейтронов с очень низкой энергией (тепловой) или с низкой энергией (эпитермальной) стабильным изотопом бора-10 (10В). Захват вызывает распад 10В и высвобождение а-частиц и частиц лития.
N + 10В -» 4Не + 7Li
Успех методики заключается в селективном накоплении 10В в опухоли при использовании меченых соединений бора, таких как 10B-BSA. Пучок низкоэнергетических нейтронов с высокой линейной энергетической передачей (LET) обладает малым рассеиванием около опухоли. Это метод изучается в нескольких центрах мира.
ж) Будущее лучевой терапии ЦНС. Лучевая терапия — один из основных методов лечения у больных с различными опухолями ЦНС, особенно злокачественными. Это положение будет сохраняться и в обозримом будущем. Тем не менее, мы приближаемся к пределу, за которым технические улучшения доставки излучения дают небольшие дополнительные преимущества. Перспектива совершенствования методов возникнет на основе нашего лучшего понимания механизмов контролирования клеточного цикла и реагирования на радиационное облучение.
– Также рекомендуем “Схема химиотерапии опухоли головного мозга – Европейские протоколы”
Оглавление темы “Нейрохирургия опухоли головного мозга.”:
- Схема лучевой терапии опухоли головного мозга – Европейские рекомендации
- Схема химиотерапии опухоли головного мозга – Европейские протоколы
- Схема адъювантного лечения опухоли мозга у ребенка – Европейские рекомендации
- Схема адъювантной терапии злокачественной глиомы головного мозга у ребенка – Европейские рекомендации
- Схема адъювантной терапии медуллобластомы у ребенка – Европейские рекомендации
- Схема адъювантной терапии эпендимомы у ребенка – Европейские рекомендации
- Новые методы лечения опухоли головного мозга и их эффективность
- Алгоритм диагностики аневризмы сосуда головного мозга – Европейские рекомендации
Источник
- Общие представления об опухолях головного мозга
- Варианты лечения опухолей головного мозга
- Что происходит во время лучевой терапии?
- Возможные побочные эффекты лучевой терапии
- Возможные риски и осложнения лучевой терапии
- Требуется ли какое-то обследование и лечение после окончания лучевой терапии?
- Новейшие достижения в области лечения опухолей головного мозга
Общие представления об опухолях головного мозга
Опухоль головного мозга представляет собой группу патологически измененных клеток, образующихся в самом мозге или вокруг него. Новообразование способно к непосредственному разрушению здоровых тканей головного мозга, а также вызывает воспаление и отек нервной ткани и содействует увеличению внутричерепного давления.
Опухоль головного мозга может быть злокачественной и доброкачественной. Злокачественное новообразование растет быстро и нередко повреждает здоровые ткани мозга, проникая в них. Доброкачественные опухоли отличаются медленным ростом и менее агрессивным поведением.
Опухоли головного мозга принято делить на две группы: первичные и метастатические. Первичные опухоли берут свое начало из тканей головного мозга. Образование метастатического очага связано с отрывом злокачественных клеток от опухолей другой локализации и проникновением их в головной мозг. По этой причине метастатические опухоли всегда являются злокачественными, тогда как первичные новообразования головного мозга могут носить как доброкачественный, так и злокачественный характер.
Классификация опухолей головного мозга учитывает локализацию очага, тип входящей в его состав ткани, характер новообразования (злокачественное или доброкачественное) и др. Если опухоль считается злокачественной, то проводится обязательное изучение ее клеток под микроскопом, что позволяет определить выраженность патологических изменений. На основании проведенного анализа можно судить о степени злокачественности и стадии опухоли. Степень злокачественности и стадия опухоли зависят от быстроты роста раковых клеток, объема кровоснабжения новообразования, наличия зон некроза (гибели клеток), степени сходства злокачественных клеток с нормальными, а также от объема распространения патологически измененных клеток на здоровые ткани.
Точная причина возникновения первичных опухолей головного мозга остается неизвестной. При развитии некоторых опухолей определенную роль играют генетические факторы и факторы внешней среды. У крайне небольшого числа пациентов развитие опухолей головного мозга связано с воздействием излучения, в том числе с терапевтическими целями, в детском возрасте.
К симптомам опухолей головного мозга относятся головные боли, тошнота и рвота, судороги, изменения в поведении, снижение памяти, а также нарушение слуха или зрения.
^Вверх^
Варианты лечения опухолей головного мозга
Существует множество вариантов лечения опухолей головного мозга. При этом выбор подходящего метода зависит от типа и размера опухоли, скорости ее роста и общего состояния здоровья пациента.
При лечении опухолей головного мозга применяются хирургические вмешательства, лучевая терапия, химиотерапия, средства прицельной биологической терапии и комбинированные методики. Для быстрого снижения внутричерепного давления лечением первого выбора обычно является хирургическая резекция опухоли.
Лучевая терапия
За два последних десятилетия ученым удалось разработать новые методики облучения опухолей головного мозга с одновременной защитой окружающих здоровых тканей. К ним относится брахитерапия, радиотерапия с модулированной интенсивностью и радиохирургические вмешательства.
Радиотерапия применяется только при тех опухолях, которые к ней чувствительны. При этом используется рентгеновское излучение, гамма-лучи или пучки протонов, которые направляются к опухоли извне, вызывают гибель раковых клеток и сокращение объемов новообразования.
Лучевая терапия занимает, как правило, несколько недель. При множественных опухолевых очагах возможно облучение всего головного мозга.
К новым методам проведения радиотерапии относится:
- Технология RapidArc®, которая подразумевает вращательные движения линейного ускорителя и обладает всеми преимуществами радиотерапии с модулированной интенсивностью (РТМИ). Распространенность данной технологии пока невелика.
- Радиотерапия с модулированной интенсивностью (РТМИ): представляет собой современный метод высокоточной лучевой терапии с использованием компьютеризированных линейных ускорителей, что обеспечивает прицельную доставку излучения к новообразованию или какой-либо области внутри него. При этом пучок лучей полностью соответствует трехмерных параметрам опухоли, в результате чего вся доза излучения целиком фокусируется на мишени, а воздействие на здоровые клетки сводится к минимуму.
- Стереотаксическая радиохирургия – это высокоточный метод радиотерапии, в ходе которой узкие пучки лучей сходятся на опухоли под разными углами. Для данной процедуры используются жесткие фиксирующие рамки на голову. Для определения точной локализации новообразования применяется КТ или МРТ, а программное обеспечение помогает врачу регулировать дозу излучения. Стереотаксическая радиотерапия подобна радиохирургическим вмешательствам, однако подразумевает фракционирование лечения, то есть разделение его на несколько сеансов. Подобный режим подходит для лечения опухолей, расположенных внутри или рядом с жизненно важными образованиями головного мозга, воздействие высоких доз излучения на которые крайне нежелательно, а также используется при обширных опухолях.
- Трехмерная конформная радиотерапия (ТКРТ): сочетает в себе возможности традиционной лучевой терапии и технологию изменения формы рентгеновского пучка, что обеспечивает его конформность (соответствие) параметрам опухоли. При этом новообразование получает максимальную дозу излучения, в то время как окружающие здоровые ткани защищены от него. При планировании лечения используется КТ и/или МРТ, поскольку ТКРТ требует максимально точного учета локализации опухоли и анатомических образований вокруг нее.
- Брахитерапия (внутренняя лучевая терапия): временное размещение радиоактивных материалов в тканях опухоли, что вызывает высвобождение высокой дозы излучения внутри нее.
При первичных опухолях головного мозга часто назначается хирургическое лечение (резекция очага). При этом удаляется вся опухоль или ее часть без существенного вреда для окружающих тканей. При невозможности удаления новообразования операция применяется для уменьшения внутричерепного давления или облегчения симптомов (так называемое паллиативное лечение).
При опухолях головного мозга также возможна химиотерапия, которая считается стандартом лечения первичных злокачественных новообразований (нередко в сочетании с лучевой терапией).
Химиотерапевтические препараты, которые замедляют рост раковых клеток или полностью их уничтожают, назначаются перед, во время или после проведения операции и/или радиотерапии, что предотвращает рецидив опухоли.
Химиотерапевтические препараты назначаются в таблетках или инъекциях, нередко в сочетании с лучевой терапией. Кроме этого, возможно использование радиосенсибилизирующих препаратов, которые увеличивают эффективность радиотерапии.
^Вверх^
Что происходит во время лучевой терапии?
Перед началом лучевой терапии пациента консультирует онколог-радиолог. В ходе консультации врач оценивает историю заболевания и проводит осмотр. Кроме этого, проводятся консультации и других специалистов, которые входят в состав группы лечащего персонала.
После выбора наиболее подходящего метода лечения начинается этап планирования радиотерапии. На данном этапе онколог-радиолог, который специализируются на проведении лучевой терапии при злокачественных опухолях, проводит моделирование лечения. При этом используется стандартная рентгенография или КТ, а также, в некоторых случаях, МРТ. Результаты обследования важны для выбора типа и направления пучка лучей.
Во время моделирования радиотерапии важно сохранять неподвижность, хотя никакое лучевое лечение в этот период не проводится. Для удержания головы пациента в определенном положении используется фиксирующая маска. Как правило, лучевая терапия начинается через 1-2 дня после составления плана лечения.
В течение каждого сеанса радиотерапии пациент неподвижно лежит на процедурном столе, в то время как радиолог или техник проводит лечение согласно назначенным онкологом параметрам. Сеанс радиотерапии занимает всего несколько минут и проходит совершенно безболезненно.
Во время стереотаксических радиохирургических вмешательств для фиксации пациента используется жесткая головная рамка. Кроме этого, в ходе процедуры проводится регулярное сканирование (КТ или МРТ), что позволяет точно отслеживать положение опухоли и регулировать дозу излучения при необходимости.
Планирование лечения и первые сеансы радиотерапии занимают 1 или 2 часа. После этого каждый сеанс длится всего несколько минут, а общее пребывание пациента в радиологическом отделении не превышает 30-45 минут. Как правило, радиотерапия проводится 1-2 раза в день, 5 дней в неделю, в течение 5-7 недель.
^Вверх^
Возможные побочные эффекты лучевой терапии
Побочные эффекты лучевой терапии при опухолях головного мозга появляются обычно через 2 недели от начала лечения. У большинства пациентов отмечается облысение, степень которого в каждом конкретном случае различна. Как правило, после завершения радиотерапии волосы отрастают вновь.
Вторым по распространенности побочным эффектом является раздражение кожи волосистой части головы и вокруг ушей, которое проявляется зудом, сухостью, покраснением и отеком. При появлении данных симптомов важно как можно скорее связаться с врачом, но не пытаться лечить их самостоятельно.
Другим возможным побочным эффектом лучевого лечения является утомляемость. Наилучшим методом борьбы с ней является достаточный отдых, здоровое питание и помощь родственников и друзей. Энергетическая активность восстанавливается обычно через 6 недель после завершения лечения.
Радиотерапия опухолей головного мозга часто сопровождается отеком нервной ткани, а поэтому о появлении головных болей или чувства давления важно сразу же сообщить врачу. Для купирования отека, профилактики судорог и уменьшения болей используются лекарственные препараты.
Более тяжелые побочные эффекты возникают при одновременном проведении радио- и химиотерапии. Для преодоления неприятных симптомов врач должен назначить соответствующее лечение.
К другим возможным побочным эффектам радиотерапии относится:
- Тошнота и рвота
- Потеря аппетита
- Проблемы со слухом
- Нарушения памяти или речи
- Головные боли
^Вверх^
Возможные риски и осложнения лучевой терапии
Излучение является мощным оружием против раковых клеток, однако в некоторых случаях повреждает и здоровые клетки и ткани головного мозга, что носит название лучевой некроз. Некроз, представляющий собой позднее осложнение лучевой терапии высокими дозами, проявляется головными болями, судорогами, а также, в крайне редких случаях, летальным исходом. Для развития лучевого некроза требуется от 6 месяцев до нескольких лет. Тем не менее, в последние годы риск развития некроза существенно снизился, что связано с появлением современных способов прицельной лучевой терапии и внедрением мощных методов визуализации, картирования головного мозга и информационных технологий.
К другим осложнениям лучевой терапии при опухолях головного мозга относится:
- Рецидив опухоли
- Неврологические расстройства
У детей излучение может повреждать гипофиз и другие отделы мозга, что проявляется замедлением роста и нарушениями психомоторного и физического развития. Помимо этого, радиотерапия в детском возрасте увеличивает риск развития злокачественных опухолей позже, в течение взрослой жизни. Цель современных исследований в области онкологии сводится к замене радиотерапии при детских опухолях головного мозга на химиотерапевтическое лечение.
^Вверх^
Требуется ли какое-то обследование и лечение после окончания лучевой терапии?
При опухолях головного мозга крайне важным является периодическое обследование у онколога. Помимо стандартного физикального и неврологического осмотра, врач может назначить МРТ, МР-спектроскопию, перфузионную или диффузионную МРТ, КТ, ПЭТ-сканирование, анализы крови или эндоскопические процедуры.
Подобное наблюдение помогает врачу:
- Выявлять любые признаки рецидива опухоли
- Наблюдать за состоянием головного мозга
- Обнаруживать и лечить побочные эффекты радио- или химиотерапии
- Диагностировать появление других типов рака на самых ранних стадиях
Кроме этого, онкологи рекомендуют домашний уход, физиотерапию и реабилитационные мероприятия, направленные на восстановление трудоспособности, адекватное обезболивание, участие в группах поддержки для больных онкологическими заболеваниями.
^Вверх^
Новейшие достижения в области лечения опухолей головного мозга
Достижения в области фракционированной и стереотаксической радиотерапии за последнее десятилетие несут надежду пациентам с опухолями головного мозга, поскольку позволяют увеличить выживаемость и качество жизни. Клинические исследования показывают эффективность целого ряда процедур и лекарственных препаратов. К ним относится:
- Генная терапия: введение в клетки опухоли генетического материала с целью их уничтожения или замедления роста.
- Ингибиторы ангиогенеза: препараты, которые нарушают рост кровеносных сосудов внутри опухоли, что вызывает ее кислородное голодание и недостаток питательных веществ. Подобное лечение называется ангиостатическим.
- Иммунотерапия – экспериментальное лечение, которое запускает иммунный ответ против отдельных опухолевых антигенов. Различные препараты иммунотерапии в настоящее время изучаются в контролируемых клинических исследованиях.
- Новые классы биологических препаратов прицельной терапии, направленных против различных звеньев метаболизма и сигнальных путей опухолевых клеток.
- Более эффективные методы доставки лекарственных препаратов, например, конвекционная доставка, изучаются в клинических исследованиях.
^Вверх^
Источник
