Противопоказания при вильсона коновалова
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.

Болезнь Вильсона
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
- брюшная
- ригидно-аритмогиперкинетическая
- дрожательно-ригидная
- дрожательная
- экстрапирамидно-корковая
Симптомы
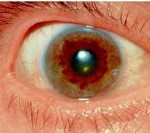
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Источник
- Причины возникновения болезни Вильсона-Коновалова
- Как лечить болезнь Вильсона-Коновалова?
- С какими заболеваниями может быть связано
- Лечение болезни Вильсона-Коновалова в домашних условиях
- Какими препаратами лечить болезнь Вильсона-Коновалова?
- Лечение болезни Вильсона-Коновалова народными методами
- Лечение болезни Вильсона-Коновалова во время беременности
- К каким докторам обращаться, если у Вас болезнь Вильсона-Коновалова
Причины возникновения болезни Вильсона-Коновалова
Болезнь Вильсона-Коновалова (гепатоцеребральная дистрофия, гепатолентикулярная дегенерация) – достаточно редкое наследственное заболевание, развивающееся вследствие нарушений обмена меди, из-за чего она сначала накапливается в печени, а затем и в других органах.
Болезнь Вильсона-Коновалова протекает с преимущественным поражением печени и ЦНС (чечевичных ядер, подкорки и коры), а также коричнево-зеленой пигментацией края роговицы, поражением почек.
Наследуется заболевание по аутосомно-рецессивному типу, опосредуется рецессивным геном, расположенным в 13-й хромосоме. Первоначально ген экспрессируется в печени, почках, плаценте. В скрытом гетерозиготном состоянии ген болезни Вильсона-Коновалова распространяется в популяции, не подвергаясь воздействию естественного отбора. Частоту гена болезни Вильсона-Коновалова разные авторы оценивают различно: от 1:200 до 1:500. Частота заболеваний выше при кровнородственных браках. Болезнь часто встречается среди евреев восточно-европейского происхождения, а также на юге Италии, в Японии, Индии, особенно в тех областях, где распространены браки между родственниками. Выявлена абсолютная конкордантность по болезни Вильсона-Коновалова у однояйцевых близнецов, а значит, гена гепатоцеребральной дистрофии высоко пенетрантен.
С пищей за сутки в организм поступает 2-5 мг меди. Она всасывается в кишечнике, поступает в печень, где связывается с синтезируемым печенью церулоплазмином, циркулирует в сыворотке крови, избирательно захватывается органами, которые в ней нуждаются, а экскретируется с желчью. Незначительная часть меди находится в крови в ионизированной форме в виде лабильного комплекса с альбумином и выделяется с мочой. При болезни Вильсона-Коновалова увеличена абсорбция меди в кишечнике, в 95% случаев снижена экскреция меди с желчью. Происходит нарушение процесса включения меди в церулоплазмин, а значит, в сыворотке крови его существенно меньше. У 5% больных с несомненной болезнью Вильсона-Коновалова определен нормальный уровень церулоплазмина в сыворотке крови. Его уровень не всегда коррелирует с длительностью и выраженностью болезни.
Также отмечается высокое содержание в крови и тканях свободной меди, а также выделение ее с мочой. Следствием недостаточного использования меди является депонирование ее в печени, мозге, почках, роговице.
Желчь – основной физиологический путь экскреции меди из печени. У здорового взрослого с желчью выделяется 1,2-1,7 мг/сутки меди, а при болезни Вильсона-Коновалова – 0,6 мг/сутки.
Патоморфологический механизм нарушения обмена меди нуждается в уточнении.
Повышенное накопление меди в головном мозге, роговице, дистальных отделах почечных канальцев приводит к развернутой картине болезни с характерными клиническими симптомами. Основными из них являются поражения печени и центральной нервной системы Печень в первую очередь подвергается токсическому воздействию меди. Неврологические проявления болезни чаще всего приходятся на возраст от 11 до 25 лет, а поражение печени у тех же больных имеется в 5-6-летнем возраст, а то и ранее.
Поражение печени может долгие годы оставаться бессимптомным или иметь стертую клиническую картину, поэтому заболевание чаше диагностируется лишь при появлении неврологической симптоматики. На начальной стадии болезни изменения в печени неспецифические:
- мелко- и среднекапельная жировая дистрофия,
- некрозы единичных гепатоцитов,
- перипортальный фиброз.
Далее поражение печени при гепатоцеребральной дистрофии протекает как хронический гепатит высокой степени. При прогрессировании процесса развивается цирроз печени с портальной гипертензией и печеночной недостаточностью.
Фульминантная печеночная недостаточность – крайне редкое, но и наиболее неблагоприятное проявление гепатоцеребральной дистрофии. Развивается обычно у подростков и молодых пациентов.
Среди неврологических симптомов следует выделить флексорно-экстензорный тремор. Его выраженность колеблется от едва заметного дрожания рук до трясения всего тела. Тремор усиливается при волнении и целенаправленных действиях. Умеренный тремор у ряда больных может иметь акцент на одной стороне. Мышечная дистония в большей или меньшей степени отмечается у всех больных. Неврологические симптомы дрожательно-ригидной формы демонстрируют различные сочетания тремора и ригидности. Кроме того, определяют гипомимию, гиперсаливацию, затрудненную монотонную речь, снижение интеллекта.
Акинетико-ригидная форма болезни сопровождается ярко выраженным ригидным синдромом, затрагивающим различные группы мышц. В развернутой стадии болезни выявляется характерный гиперкинез, к которому могут присоединиться интенционный компонент, дизартрия и дисфагия, мозжечковые расстройства, миоклонии. Отмечаются гиперсаливация, макроглоссия, снижение интеллекта. Без специфической терапии нарастание симптоматики приводит к выраженным контрактурам, обездвиженности, грубой деменции.
Поражение почек при гепатоцеребральной дистрофии проявляется периферическими отеками, микрогематурией, незначительной протеинурией, повышением концентрации креатинина сыворотки крови. Как ранний симптом может наблюдаться макро- и микрогематурия. Характерны канальцевые нарушения: аминоацидурия, глюкозурия, фосфатурия, микрогематурия.
Клиническое улучшение под влиянием лечения выражается в сглаживании неврологической симптоматики, снижении активности воспалительного процесса в печени.
Как лечить болезнь Вильсона-Коновалова?
Лечение болезни Вильсона-Коновалова обычно представляет собой патогенетическую терапию, направленную на выведение избытка меди из организма для предупреждения ее токсического воздействия. Актуальны препараты, связывающие и выводящие медь из организма (БАЛ, унитинол). Применение БАЛ ограничено из-за болезненности инъекций и появления признаков интоксикации при длительном лечении.
D-пеницилламин получил наибольшее распространение при лечении гепатоцеребральной дистрофии. Механизм действия препарата точно не установлен, предполагают, что он образует такие соединения с медью, которые легко фильтруются через почечные клубочки, то есть увеличивается выведение меди с мочой. При успешной терапии выведение меди с мочой увеличивается в 3-5 раз. В литературе есть описания полного исчезновения клинических симптомов и исчезновения активности хронического гепатита и цирроза по данным биопсии печени спустя годы после применения препарата. Возможны гематологические, почечные и кожные осложнения.
Злокачественный агранулоцитоз, преходящая тромбо- и лейкопения наиболее часто наблюдаются в первые 6 недель лечения, контрольные анализы крови вначале делают 3 раза в неделю, а затем 1 раз в месяц.
Противопоказанием к лечению D-пеницилламином служат лейкопения, тромбоцитопения, а также прекома и кома. При выраженных токсических эффектах применяется другое хелатобразующее соединение – триэтилентетрамин. При непереносимости обоих веществ применяется тетратиомолибдат. Препарат блокирует всасывание меди из кишечника, а также связывает медь в тканях в метаболически инертной форме. Среди побочных эффектов подавление костномозгового кроветворения и деструкция костей, в связи с чем ограничено применение препарата у детей.
Альтернативный метод лечения – применение значительно менее токсичного, чем D-пеницилламин, сульфата цинка: он тормозит абсорбцию меди в кишечнике.
В лечении гепатоцеребральной дистрофии широко применяют витамины В1 и В6, так как при этом заболевании избыточные количества меди блокируют их активность. Показаны препараты, улучшающие обмен гепатоцитов, антиоксиданты.
Трансплантация печени показана больным гепатоцеребральной дистрофией, проявляющейся фульминантной печеночной недостаточностью, и при прогрессировании печеночной недостаточности на фоне хронического гепатита и цирроза печени при неэффективности медикаментозной терапии.
Течение болезни прогрессирующее, ведущее к инвалидности. Прогноз значительно улучшился с применением D-пеницилламина; на ранних стадиях болезни он в ряде случаев способствует нормализации клинической картины и сохранению работоспособности.
С какими заболеваниями может быть связано
Известно, что билиарный цирроз или атрезия желчных протоков, а также холестаз любой другой этиологии могут вызвать значительную задержку меди. Важно отметить, что уровень церулоплазмина у этих больных остается нормальным. Некоторые авторы постулируют гипотезу, что генетический дефект при болезни Вильсона-Коновалова обусловлен ослаблением билиарной экскреции меди и, возможно, ответствен за отложение меди в тканях.
В последней стадии болезни усиленное накопление меди в печени приводит к фиброзу и циррозу печени.
Острый внутрисосудистый гемолиз часто осложняет течение болезни Вильсона-Коновалова, у 15% больных могут наблюдаться его клинические проявления. Гемолиз обычно временный, проходит самостоятельно, предшествуя ярким клиническим признакам поражения печени в течение нескольких лет.
При болезни Вильсона-Коновалова может наблюдаться костно-суставной синдром с остеопорозом или остеомаляцией, поражением коленных суставов и позвоночника.
Если развивается фульминантная печеночная недостаточность, ей обычно сопутствует гемолитическая анемия, связанная с массивным освобождением меди из печени.
Нефротический синдром выявляется обычно в период от 2 месяцев до 2 лет после начала лечения. Он может исчезать спонтанно или при применении глюкокортикоидов.
Кожные осложнения – локальная и генерализированная эритема, уртикарные высыпания, геморрагические кожные экстравазаты, сухость кожи лица; при очень длительном применении препарата иногда возникают глубокие язвы на конечностях, чаще на голенях.
Из других осложнений возможны диспепсические расстройства, снижение или потеря вкуса.
Лечение болезни Вильсона-Коновалова в домашних условиях
В рамках патогенетической терапии назначается диета №5. Она богата белком и ограничена в количестве меди. Исключаются из рациона баранина, куры, утки, колбасы, рыба, ракообразные, шампиньоны, кресс-салат, щавель, лук-порей, редис, бобовые, орехи, чернослив, каштаны, шоколад, какао, мед, перец и т.п.
Медикаментозное лечение обычно проводят пожизненно. Доза препарата должна устанавливаться ежегодно, а при длительном лечении каждые 2 года на основании выделения меди с мочой, контрольных биопсий печени и определения содержания меди в биоптатах печени.
Какими препаратами лечить болезнь Вильсона-Коновалова?
Используются препараты, связывающие и выводящие медь из организма:
- БАЛ – британский антилюизит (2,3-димеркаптопропанол), вводят внутримышечно по 1,25-2,5 мг/кг 2 раза в день в течение 10-20 дней, перерыв между курсами 20 дней;
- унитиол (5% раствор) – по 5-10 мл ежедневно или через день, на курс 25-30 внутримышечных инъекций; повторные курсы через 2-3 месяца;
- D-пеницилламин – 0,3-1,3 до 3-4 г/сутки в зависимости от величины экскреции меди с мочой; оптимальная доза препарата 0,9-1,2 г/сутки;
- сульфат цинка – 200 мг 3 раза в день за 30 минут до еды.
Лечение болезни Вильсона-Коновалова народными методами
Лечение народными средствами в случае с наследственными заболеваниями не способно произвести достаточный эффект, а потому не применяется.
Лечение болезни Вильсона-Коновалова во время беременности
Лечение болезни Вильсона-Коновалова в период беременности не изучено в полной мере, поскольку заболевание редкое и наследственное. Не все больные доживают до репродуктивного возраста. В то же время известны случаи беременностей у женщин-носителей гена болезни.
Профилактика заключается в раннем обнаружении гетерозиготного наследования. Существенное значение для успеха терапии и предотвращения тяжелых поражений нервной системы и печени имеет ранняя диагностика болезни. При выявлении дефектного гена в гомозиготном состоянии лечение медьхелатирующими препаратами может быть начато в возрасте 3 года и старше.
К каким докторам обращаться, если у Вас болезнь Вильсона-Коновалова
- Гастроэнтеролог
- Гепатолог
Болезнь Вильсона-Коновалова может десятилетиями проявляться признаками цирроза печени. Правильной диагностике способствуют выявление кольца Кайзера-Флейшера, исследование активности церулоплазмина, биопсия печени.
Диагноз можно установить на основании типичной клинической картины:
- поражение печени и нервной системы
- семейный характер заболевания,
- кольцо Кайзера-Флейшера на роговице при исследовании с помощью щелевой лампы.
Подозрение на наличие гепатоцеребральной дистрофии должно возникнуть при:
- неуточненной этиологии хронического гепатита и цирроза;
- фульминантной печеночной недостаточности;
- необъяснимом повышении уровня аминотрансфераз;
- наличии соответствующих неврологических изменений неустановленной этиологии, изменении поведения;
- психических симптомах, сочетающихся с признаками заболевания печени;
- необъяснимой приобретенной гемолитической анемии;
- семейном анамнезе по гепатоцеребральной дистрофии.
Подтверждают диагноз данные о нарушении обмена меди – снижение или отсутствие активности церулоплазмина в сыворотке крови (обычно 0-200 мг/л при норме 350+100 мг/л). Эти данные выявляют у 95 % больных и 10 % здоровых гетерозиготных носителей.
Для количественного определения меди в биоптатах печени используют атомноабсорбционную спектрофотометрию, рентгеноструктурный анализ. Гистологическое выявление меди производится с помощью окраски рубеановой кислотой, роданином и орсеином, но диагностическое значение их ограничено. Трудности в диагностике могут возникнуть при изолированном поражении печени и у детей без клинической симптоматики.
При фульминантной печеночной недостаточности в отличие от острых вирусных и токсических поражений печени повышение активности аминотрансфераз не столь резко выражено. Повышено содержание меди в сыворотке крови. При гистологическом исследовании выявляются микровезикулярная жировая дистрофия печени, коагуляционные некрозы гепатоцитов. Единственным эффективным методом лечения является трансплантация печени.
Лечение других заболеваний на букву – б
Информация предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. EUROLAB не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
Источник
