Свойства металлов и их свойства и противопоказания

Для успешного создания декоративных изделий необходимо знать основные свойства исходного материала, а также технологию работы с ним.
В наши дни для изготовления посуды, украшений и различных предметов дизайна интерьера могут использоваться как металлы в чистом виде, так и их сплавы.
 Художественное изделие — ваза из серебра
Художественное изделие — ваза из серебра
Все металлы и сплавы, созданные на их основе, делятся на две большие группы, обладающие различными свойствами:
- Черные металлы — сталь
- Цветные металлы — медь, бронза, латунь, цинк, олово, алюминий, свинец и серебро.
Именно эти виды металлов наиболее часто используются для изготовления декоративных предметов, посуды и многого другого. Поэтому давайте рассмотрим их свойства и особенности обработки металлов.
Сталь
Сталь относится к черным металлам. Для художественной обработки лучше всего подходит углеродистая сталь, которая представляет собой сплав железа с углеродом и другими элементами. Сталь обладает высокими качественными характеристиками, среди которых можно назвать следующие:
- Упругость
- Прочность
- Способность к закаливанию — кусок стали нагревается при высокой температуре докрасна, а затем опускают в воду. Благодаря этому металл приобретает различные степени твердости и упругости.
- Возможность » отпускания» посредством нагревания до красного каления и последующего медленного охлаждения.
- Способность к обработке кузнечным молотом в нагретом состоянии, так как сталь отлично куется.
- Возможность к разрезанию металла на тонкие полосы.
Мягкость стали прямо пропорциональная количеству углерода в ее составе. Чем меньше в металле углерода, тем он мягче и легче в обработке. Мягкость стали повышается при отжиге, то есть » отпускании» металла. Для этого сталь нагревают докрасна, а затем подвергают процедуре медленного охлаждения.
Сталь для изготовления различных изделий и художественной обработки производят в виде сортового материала. Для гравирования и чеканки чаще всего используют стали У8 и У10, где буквой » У» обозначено количество углерода в составе сплава.
 Лезвие ножей изготовлено из нержавеющей углеродистой стали
Лезвие ножей изготовлено из нержавеющей углеродистой стали
Цветные металлы
Цветные металлы стоят намного дороже черных, потому что они обладают множеством уникальных свойств. Главным из них является отсутствие реакции с магнитом, то есть цветные металлы не притягиваются и не намагничиваются. Кроме этого, большинство из них практически не поддаются окислению, поэтому изделия характеризуются длительностью срока службы.
Выпуск цветных металлов для художественной обработки осуществляется в различных видах:
- Ленты
- Полосы
- Чушки
- Трубки
- Проволока
- Прутки
- Листы
Давайте рассмотрим характерные особенности наиболее популярных среди мастеров цветных металлов:
- Медь — достаточно мягкий металл красивого красно — оранжевого оттенка, характеризующийся повышенной способностью к ковке и обладающий большой электропроводностью и способностью проводить тепло. Обработка меди не представляет особой сложности, но мастер должен иметь в виду большую вязкость данного металла.
Медь можно паять с помощью олова и твердого припоя, Листовая медь является основным материалом для выполнения чеканки и граверных работ. Медная проволока используется для изготовления декоративных изделий и ажурных скульптур.
 Медная раковина
Медная раковина
- Бронза — это сплав меди с оловом. Количественное содержание олова влияет на цвет сплава, который может приобретать розовые, красные, желтые или серые оттенки. Если бронзовое изделие покрыть слоем патины ( декоративным налетом из оксида меди), то она приобретает благородный дымчато — зеленоватый оттенок и выглядит старинной и по — настоящему дорогой. Бронза чаще всего используется для инкрустации и литейных работ.
 Листовая бронза
Листовая бронза
- Латунь — это сплав меди с цинком. Оттенок металла зависит от количества цинка. По своим качественным характеристикам латунь является более твердым сплавом, чем чистая красная медь, поэтому степень ее ковкости значительно ниже. По сравнению с медью латунь обладает некоторой хрупкостью, но вместе с тем она более упруга.
Латунь легко поддается различным видам обработки, в частности, ее можно использовать для изготовления тонких деталей в инкрустациях, а также украшений различной конфигурации. Для чеканных работ используется в листовом виде.
 Чеканка на латуни
Чеканка на латуни
- Цинк — прекрасно подходит для литья как в чистом виде, так и в сплавах с другими металлами. Чистый цинк куется плохо, однако его легко паять, гравировать и обрабатывать различными инструментами. Температура плавления составляет 419* С.
 Листовой цинк
Листовой цинк
- Олово — цветной металл, с давних пор известный своей мягкостью и пластичностью. Температура его плавления составляет всего 252* С. В качестве компонента олово входит в состав различных видов бронзы. На изломе олово издает характерный, узнаваемый хруст. Чистое олово и его сплавы идеально подходят для изготовления инкрустаций. А еще олово используется для лужения и пайки посуды как в чистом виде, так и в сплавах со свинцом. При этом продукты его окисления безвредны.
 Набор оловянных солдатиков
Набор оловянных солдатиков
- Алюминий — цветной металл серебристо — белого цвета, который плавится при температуре около 658* С. Характерной особенностью алюминия является его легкость и простота в обработке металла. Литой алюминий достаточно хрупкий, а в прокатном ( отожженном) виде он приобретает желаемую пластичность.
 Алюминиевые изделия ремесленников Мадагаскара
Алюминиевые изделия ремесленников Мадагаскара
- Свинец — мягкий цветной металл, имеющий синевато — серый оттенок. Он плавится при температуре 327* С, и хорошо противостоит коррозии. Однако следует отметить, что оксиды свинца являются ядовитыми. Свинец пригоден для литейных работ и изготовления формовых изделий.
 Свинец ( эталон)
Свинец ( эталон)
- Серебро — также относится к цветным, но при этом является еще и драгоценным металлом. Чистое серебро слишком мягкое, и поэтому его неудобно обрабатывать. Для изготовления изделий применяется в виде сплавов с медью. Серебряные вставки используются в инкрустациях, в гравировке, чеканке и черни.
 Антикварные серебряные изделия
Антикварные серебряные изделия
Свойства металлов
Рассмотрим некоторые свойства металлов, влияющие на качество выполнения художественных изделий:
- Ковкость металла — ковкие пластичные металлы требуют большей силы резания, но при этом необходимо учитывать их вязкость. Кусок меди или свинца нужно рубить до конца, а латунь, цинк или сталь можно надколоть зубилом, а после просто сломать. Более твердая латунь при обточке дает гладкую поверхность, в то время как алюминий или медь как бы тянутся за резцом.
- Хрупкость — это способность твердых материалов разрушаться вследствие механического воздействия без заметной пластической деформации. Это свойство противоположно пластичности. Сильно закаленная сталь, а также многие сорта латуни и бронзы являются очень хрупкими, и от сильных ударов раскалываются на куски. Хрупкость металла не всегда является признаком его твердости, например, отливка из цинка хрупкая, но не твердая. Закаленный стальной нож одновременно и тверд, и хрупок.
- Упругость — это свойство металлов восстанавливать свою форму и объем после прекращения действия внешних сил или нагревания, вызвавших деформацию. В большой степени этим свойством обладают специальные сорта стали.
- Плавление при нагревании — способность металла плавиться при нагревании является важным качеством, так как плавление считается одним из самых доступных и дешевых способов получения изделий из металла. Детали огромных машин и маленькие металлические скульптуры изготовляются одинаковым способом.
Если возникает необходимость закалить деталь, и при этом сохранить вязкость металла, мастера используют токи высокой частоты. При этом деталь закаляется в глубину на несколько миллиметров. Однако вся остальная масса металла внутри изделия остается без изменений. И, наконец, металлические детали можно обрабатывать без нагревания — например, способом гравировки и резьбы по металлу.
 Серебряные изделия
Серебряные изделия
Источник
Не секрет, что все вещества в природе делятся на три состояния: твердые, жидкие и газообразные. А твердые вещества в свою очередь делятся на металлы и неметаллы, разделение это нашло свое отображение и в таблице химических элементов великого химика Д. И. Менделеева. Наша сегодняшняя статья о металлах, занимающих важное место, как в химии, так и во многих других сферах нашей жизни.
Химические свойства металлов
Все мы, так или иначе, но сталкиваемся с химией в нашей повседневной жизни. Например, во время приготовления еды, растворение поваренной соли в воде является простейшей химической реакцией. Вступают в разнообразные химические реакции и металлы, а их способность реагировать с другими веществами это и есть их химические свойства.
Среди основных химических свойств или качеств металлов можно выделить их окисляемость и коррозийную стойкость. Реагируя с кислородом, металлы образуют пленку, то есть проявляют окисляемость.
Аналогичным образом происходит и коррозия металлов – их медленное разрушение по причине химического или электрохимического взаимодействия. Способность металлов противостоять коррозии называется их коррозийной стойкостью.

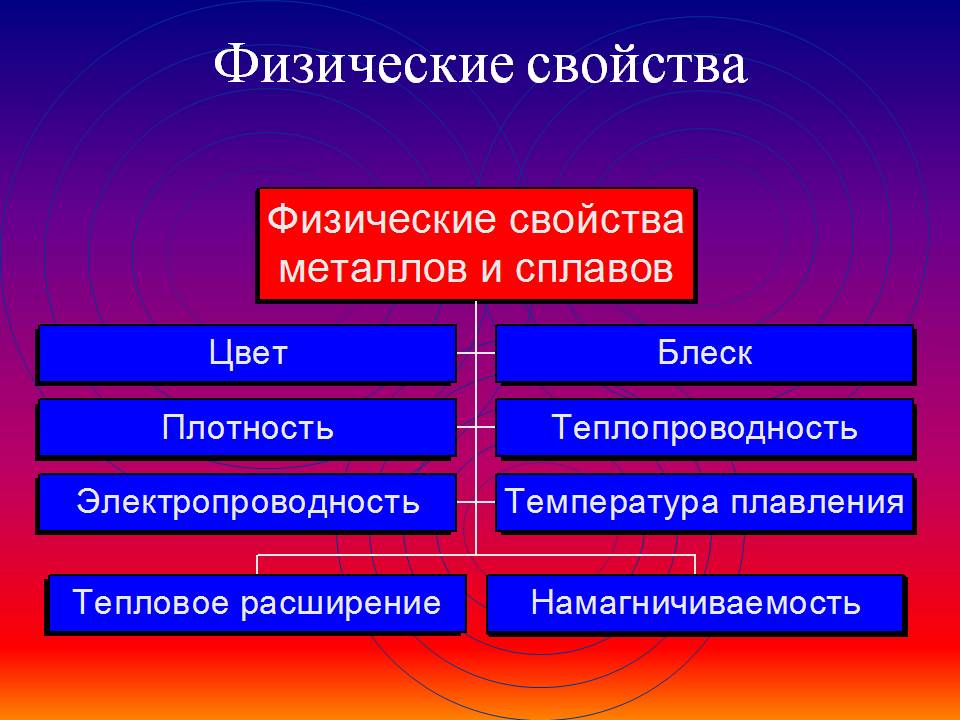
Физические свойства металлов
Среди основных общих физических свойств металлов можно выделить:
- Плавление.
- Плотность.
- Теплопроводность.
- Тепловое расширение.
- Электропроводность.
Важным физическим параметром металла является его плотность или удельный вес. Что это такое? Плотность металла – это количество вещества, которое содержится в единице объема материала. Чем меньше плотность, тем металл более легкий. Легкими металлами являются: алюминий, магний, титан, олово. К тяжелым относятся такие металлы как хром, марганец, железо, кобальт, олово, вольфрам и т. д. (в целом их имеется более 40 видов).
Способность металла переходить из твердого состояния в жидкое, именуется плавлением. Разные металлы имеют разные температуры плавления.

Скорость, с которой в металле проводится тепло при нагревании, называется теплопроводностью металла. И по сравнению с другими материалами все металлы отличаются высокой теплопроводностью, говоря по-простому, они быстро нагреваются.
Помимо теплопроводности все металлы проводят электрический ток, правда, некоторые делают это лучше, а некоторые хуже (это зависит от строения кристаллической решетки того или иного металла). Способность металла проводить электрический ток называется электропроводностью. Металлы, обладающие отличной электропроводностью, это золото, алюминий и железо, именно поэтому их часто используют в электротехнической промышленности и приборостроении.
Механические свойства металлов
Основными механическими свойствами металлов является их твердость, упругость, прочность, вязкость и пластичность.
При соприкосновении двух металлов могут образоваться микро вмятины, но более твердый металл способен сильнее противостоять ударам. Такая сопротивляемость поверхности металла ударам извне и есть его твердость.
Чем же твердость металла отличается от его прочности. Прочность, это способность металла противостоять разрушению под действием каких-либо других внешних сил.
Под упругостью металла понимается его способность возвращать первоначальную форму и размер, после того как нагрузка, вызвавшая деформацию металла устранена.
Способность металла менять форму под внешним воздействием называется пластичностью.
Технологические свойства металлов
Технологические свойства металлов и сплавов важны в первую очередь при их производстве, так как от них зависит способность подвергаться различным видам обработки с целью создания разнообразных изделий.
Среди основных технологических свойств можно выделить:
- Ковкость.
- Текучесть.
- Свариваемость.
- Прокаливаемость.
- Обработку резанием.
Под ковкостью понимается способность металла менять форму в нагретом и холодном состояниях. Ковкость метала, была открыта еще в глубокой древности, так кузнецы, занимающиеся обработкой металлических изделий, превращением их в мечи или орала (в зависимости от потребности) на протяжении многих веков и исторических эпох были одной из самых уважаемых и востребованных профессий.

Способность двух металлических сплавов при нагревании соединяться друг с другом называют свариваемостью.
Текучесть металла тоже очень важна, она определяет способность расплавленного метала растекаться по заготовленной форме.
Свойство металла закаливаться называется прокаливаемостью.
Интересные факты о металлах
- Самым твердым металлом на Земле является хром. Этот голубовато-белый метал был открыт в 1766 году под Екатеринбургом.
- И наоборот, самыми мягкими металлами являются алюминий, серебро и медь. Благодаря своей мягкости они нашли широкое применение в разных областях, например, в электроаппаратостроении.
- Золото – которое на протяжении веков было самим драгоценным металлом имеет и еще одно любопытное свойство – это самый пластичный металл на Земле, обладающий к тому же отличной тягучестью и ковкостью. Также золото не окисляется при нормальной температуре (для этого его нужно нагреть до 100С), обладает высокой теплопроводностью и влагоустойчивостью. Наверняка все эти физические характеристики делают настоящее золото таким ценным.
- Ртуть – уникальный металл, прежде всего тем, что он единственный из металлов, имеющий жидкую форму. Причем в природных условиях ртути в твердом виде не существует, так как ее температура плавления -38С, то есть в твердом состоянии она может существовать в местах, где просто таки очень холодно. А при комнатной температуре 18С ртуть начинает испаряться.
- Вольфрам интересен тем, что это самый тугоплавкий металл в мире, чтобы он начал плавиться нужна температура 3420С. Именно по этой причине в электрических лампочках нити накаливания, принимающие основной тепловой удар, изготовлены из вольфрама.
Металлы, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Общие физические свойства металлов
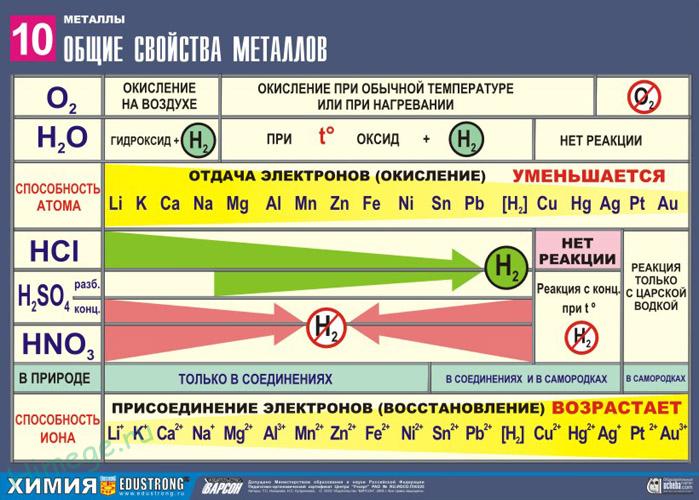
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. Реакции металлов с неметаллами
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
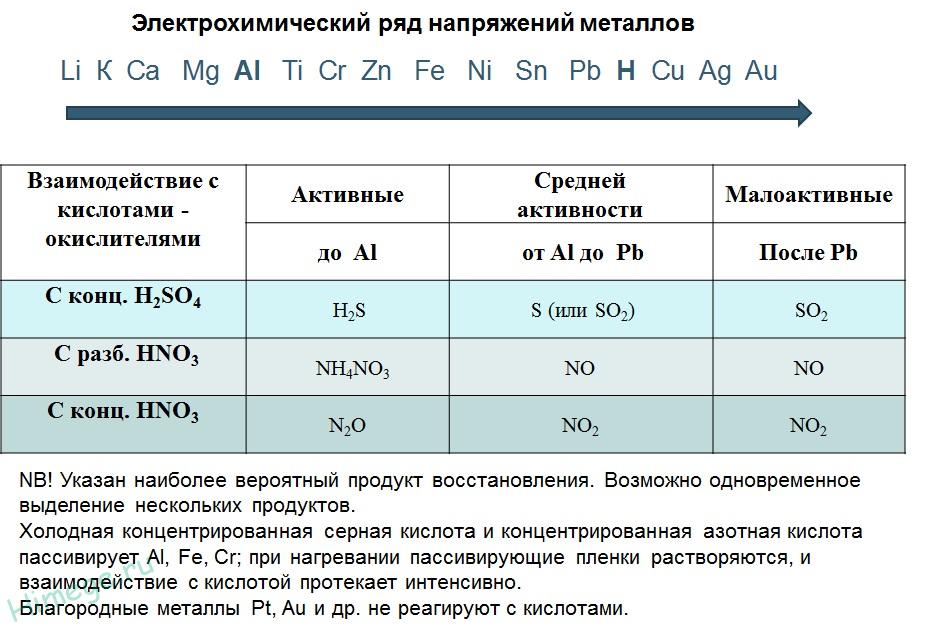
2. Реакции металлов с кислотами
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. Взаимодействие металлов с водой
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия). Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара. Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Источник
