Углерод свойства химические свойства и противопоказания
Характеристика углерода. Свойства простых веществ и соединений
 Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
Атом углерода имеет 6 электронов: 1s22s22p2. Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх, а другой, либо 2ру, либо 2рz-орбитали.
 Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Это явление, как известно, называют sp3-гибридизацией, а возникающие функции – sp3-гибридными. Образование четырех sp3-cвязeй обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи. Помимо sp3-гибридизации у атома углерода наблюдается также sp2— и sp-гибридизация. В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp2— гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу. Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp2.

При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.

Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp2-гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил. Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода. Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества.
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
— с некоторыми металлами образует карбиды
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
— с водородом — метан (а также огромное количество органических соединений)
C0 + 2H2 = CH4
— с кремнием, образует карборунд (при 2000 °C в электропечи):
Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита. В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3*CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.

Неорганические соединения углерода
Ни ионы С4+ , ни С4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
Получение
1) В промышленности (в газогенераторах):
C + O2 = CO2
CO2 + C = 2CO
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO
H2C2O4 = CO + CO2 + H2O
Химические свойства
При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
1) с кислородом
2C+2O + O2 = 2C+4O2
2) с оксидами металлов
C+2O + CuO = Сu + C+4O2
3) с хлором (на свету)
CO + Cl2 –hn= COCl2(фосген)
4) реагирует с расплавами щелочей (под давлением)
CO + NaOH = HCOONa (формиат натрия)
5) с переходными металлами образует карбонилы
Ni + 4CO –t°= Ni(CO)4
Fe + 5CO –t°= Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°= CaO + CO2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl = CaCl2 + H2O + CO2
NaHCO3 + HCl = NaCl + H2O + CO2
Химические свойства СO2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 = Na2CO3
2NaOH + CO2 = Na2CO3 + H2O
NaOH + CO2 = NaHCO3
При повышенной температуре может проявлять окислительные свойства
С+4O2 + 2Mg –t°= 2Mg+2O + C0
Качественная реакция
Помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Угольная кислота и её соли
H2CO3 — Кислота слабая, существует только в водном растворе:
CO2 + H2O ↔ H2CO3
Двухосновная:
H2CO3 ↔ H+ + HCO3— Кислые соли — бикарбонаты, гидрокарбонаты
HCO3— ↔ H+ + CO32- Cредние соли — карбонаты
Характерны все свойства кислот.
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 –t°= Na2CO3 + H2O + CO2
Na2CO3 + H2O + CO2 = 2NaHCO3
Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
CuCO3 –t°= CuO + CO2
Качественная реакция — «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CO32- + 2H+ = H2O + CO2
Карбиды
Карбид кальция:
CaO + 3 C = CaC2 + CO
CaC2 + 2 H2O = Ca(OH)2 + C2H2 .
Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
2 LaC2 + 6 H2O = 2La(OH)3 + 2 C2H2 + H2.
Be2C и Al4C3 разлагаются водой с образованием метана:
Al4C3 + 12 H2O = 4 Al(OH)3 = 3 CH4.
В технике применяют карбиды титана TiC, вольфрама W2C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na2CO3 + 2 NH3 + 3 CO = 2 NaCN + 2 H2O + H2 + 2 CO2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
C=O: [:C=N:]–
Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
2 Au + 4 KCN + H2O + 0,5 O2 = 2 K[Au(CN)2] + 2 KOH.
При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды:
KCN + S = KSCN.
При нагревании цианидов малоактивных металлов получается дициан: Hg(CN)2 = Hg + (CN)2. Растворы цианидов окисляются до цианатов:
2 KCN + O2 = 2 KOCN.
Циановая кислота существует в двух формах:
H-N=C=O; H-O-C=N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH4OCN = CO(NH2)2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC)2) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO2 + 2 NH3 = CO(NH2)2 + H2O. При 1300С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H2CO3 – слабая кислота (К1 =1,3·10-4; К2 =5·10-11). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
H2CO3 ↔ H+ + HCO3— .
При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO2 + H2O ↔ H2CO3 .
При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
H+ + CO32-↔ HCO3—
CaCO3(тв.) ↔ Ca2+ + CO32-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na2CO3) используется в производстве стекла.
Источник
Углерод – важнейший химический элемент периодической таблицы Менделеева. Без него, как и без кислорода и водорода немыслимой была бы сама Жизнь. Можно без преувеличения сказать, что жизнь всех живых существ от амебы до человека построена именно из соединений углерода. Углерод – биогенный элемент составляющий основу жизни на нашей планете. Будучи структурной единицей огромного числа различных органических соединений, он участвует и в построении живых организмов и в обеспечении их жизнедеятельности. Даже возникновение самой Жизни рассматривается учеными как сложный процесс эволюции углеродных соединений. А какие химические и физические свойства этого чудесного элемента, история его открытие и современное применение в химии, читайте об этом далее.
История открытия углерода
На самом деле углерод был известен человеку еще с глубокой древности в виде своих аллотропных модификаций: алмаза и графита. Помимо этого углерод в виде древесного угля активно применялся при выплавке металлов. От угля происходит и само название углерода, как химического элемента.
Но в те далекие времена люди пользовались углеродом в виде угля, или любовались им же, в виде алмазов, неосознанно, без понимания того, какой важный химический элемент стоит за всем этим.
Научное открытие углерода произошло в 1791 году, когда английский химик Теннант впервые получил свободный углерод. Для получения углерода он пропускал пары фосфора над прокаленным мелом. В результате этой химической реакции образовались фосфат кальция и чистый углерод. Впрочем, этому опыту предшествовали и другие искания, например выдающийся французский химик Лавуазье поставил опыт по сжиганию алмаза при помощи большой зажигательной машины. Драгоценный алмаз сгорел без остатка, после чего ученый пришел к выводу, что алмаз представляет собой ничто иное как кристаллический углерод.

Интересно, что в этих опытах совместно с алмазом пробовали сжигать и другие драгоценные камни, к примеру, рубин. Но другие камни выдерживали высокую температуру, только алмаз сгорал без остатка, что и обратило внимание на его отличную химическую природу.
Углерод в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. Атомная масса углерода составляет 12,011, согласно ней он занимает почетное 6-е место в таблице Менделеева и обозначается латинской литерой С.
Помимо этого следует обратить внимание на следующие характеристики углерода:
- Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892%) и 13С (1,108%)
- Помимо этого известно 6 радиоактивных изотопов углерода. Один из них, изотоп 14С с периодом полураспада 5,73*103 лет в небольших количествах образуется в верхних слоях атмосферы нашей планеты под действием космического излучения.
Строение атома углерода
Атом углерода имеет 2 оболочки (как впрочем, и все элементы, расположенные во втором периоде) и 6 электронов: 1s22s22p2. Четыре валентных электрона находятся на внешнем электронном уровне атома углерода. А оставшиеся два электрона находятся на отдельных p-орбиталях, при этом они являются неспаренными.
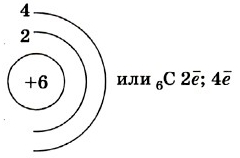
Так на картинке изображена схема электронного строения атома углерода.
Физические свойства углерода
Своими физическими свойствами углерод типичный неметалл. При этом он образует множество аллотропных модификаций («аллотропные» означает существование двух и более разных веществ из одного химического элемента): наиболее популярными из них являются алмаз, графит, уголь, сажа. При этом алмаз – одно из самых твердых веществ, представляющих углерод.
Разумеется, разные аллотропные модификации углерода имеют и разные физические свойства. Если алмаз типичное твердое тело, то, к примеру, жидкий углерод, который можно получить только при определенном внешнем давлении, обладает совершенно иными физическими свойствами, нежели алмаз или графит.
Химические свойства углерода
В обычных условиях углерод, как правило, химически инертен, но при высоких температурах он может вступать в химические взаимодействия со многими другими элементами, обычно проявляя сильные восстановительные свойства. Приведем примеры химических реакций углерода как восстановителя с:
— с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание:
2C0 + O2 –t°= 2C+2O угарный газ
— со фтором
С + 2F2 = CF4
— с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом, выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Порой углерод может выступать и как окислитель, образуя карбиды при вступлении в химические реакции с некоторыми металлами:
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
Вступая в реакцию с водородом, углерод образует метан:
C0 + 2H2 = CH4
Углерод в природе
В земной коре содержание углерода составляет всего лишь 0,15%. Несмотря на эту кажущуюся маленькой цифру, стоит заметить, что углерод непрерывно участвует в природном круговороте из земной коры через биосферу в атмосферу и наоборот. Также именно из углерода состоят такие ценные ресурсы как нефть, уголь, торф, известняки и природный газ. И как мы писали в начале нашей статьи, углерод – основа жизни. Скажем, в теле взрослого человека с весом в 70 кг имеется около 13 кг углерода. Это только в одном человека, примерно в таких же пропорциях углерод содержится в телах всех других живых существ, растений и животных.
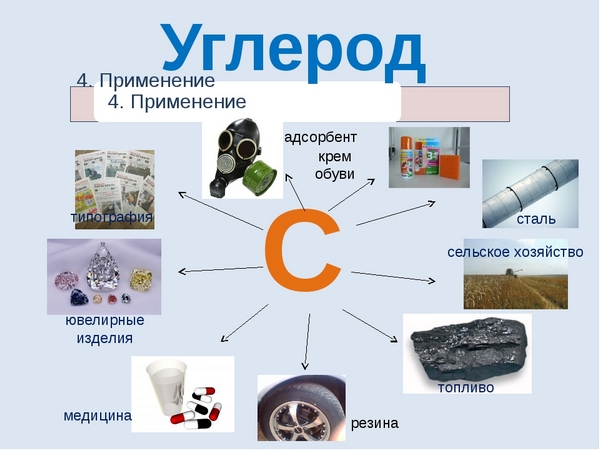
Применение углерода
Можно сказать, что углерод неразрывно связан с самим развитием человеческой цивилизации. Именно из соединений с участием углерода образованы основные топлива, благодаря которым ездят машины, летают самолеты, вы можете приготовить себе еду и обогреть свой дом в холодную пору – это нефть и газ. Помимо этого соединения углерода активно используются в химической и металлургической промышленности, в фармацевтике и строительстве. Алмазы, будучи аллотропной модификацией углерода используются в ювелирном деле и ракетостроении. В целом промышленность современности не может обойтись без углерода, он необходим практически везде.

Рекомендованная литература и полезные ссылки
- Savvatimskiy, A (2005). “Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)”. Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ChemNet. Углерод: история открытия элемента.
- Лейпунский О. И. Об искусственных алмазах (рус.) // Успехи химии. — Российская академия наук, 1939. — Вып. 8. — С. 1519—1534.
- Seal M. The effect of surface orientation on the graphitization of diamond. // Phis. Stat. Sol., 1963, v. 3, p. 658.
Углерод, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s 2s 2p
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s 2s 2p
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства
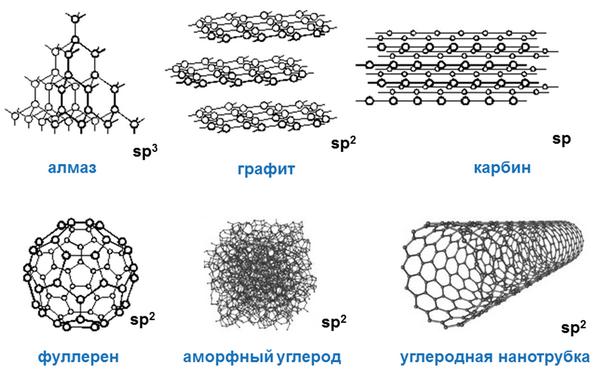
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.


Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.


Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n


Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.

В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2

Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2не поддерживает горение. Угарный газ CO горит голубым пламенем.

Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2 угольная кислота H2CO3 карбонаты MeCO3 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
2ZnO + C → 2Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C +2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C +4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами Например: SiC, B4C | Это соединения с металлами, в которых с.о. углерода равна -4 Например: Al4C3, Be2C | Это соединения с металлами, в которых с.о. углерода равна -1 Например: Na2C2, CaC2 | Это соединения с металлами, при гидролизе которых образуется пропин Например: Mg2C3 |
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли: Например: Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 | Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли: Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 | Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли Например: Mg2C3 + 4HCl → 2MgCl2 + С3Н4 |
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO3→ 3SiO2 + 3CO2 + 8NO + 4H2O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительн
